Datos del perfil de eficacia

WELIREG® está indicado en pacientes adultos con carcinoma avanzado de células renales (RCC) recaídos a terapias antiangiogénicas y de puntos de control inmunitarios.1
DESCUBRA WELIREG (belzutifan), EL INHIBIDOR DE HIF-2α APROBADO PARA PACIENTES CON CARCINOMA DE CÉLULAS RENALES AVANZADO (RCC)1
LITESPARK-005: WELIREG (belzutifan) demostró una PFS superior vs. everolimus en el primer análisis interino1,10
Estimaciones de Kaplan-Meier de la PFS en LITESPARK-0051.10
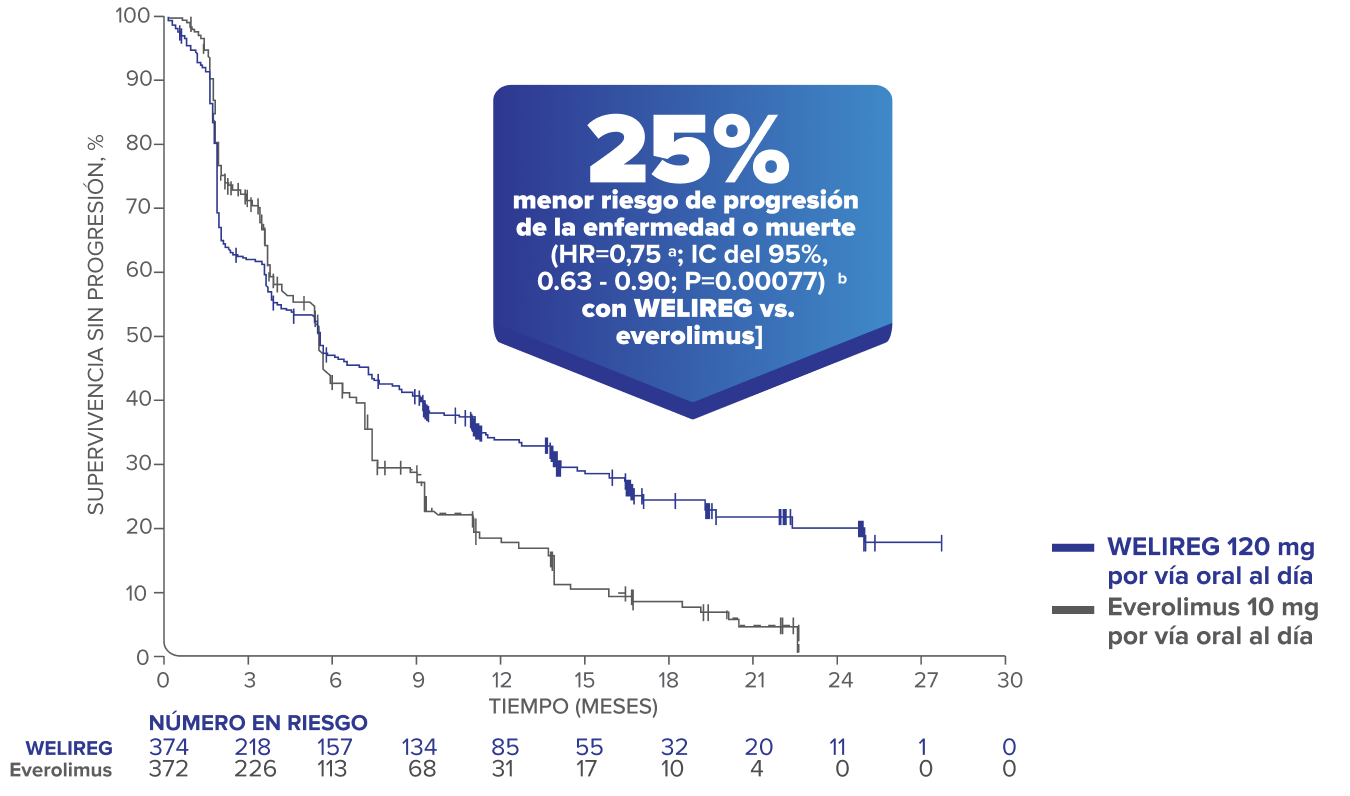
- 25% de reducción en el riesgo de progresión de la enfermedad o muerte demostrada con WELIREG frente a everolimus (HR = 0.75a IC del 95%, 0.63 – 0.90; P=0.002).1,b
- Eventos observados: 257/374 (68.7%) con WELIREG vs. 262/372 (70.4%) con everolimus.10
- Mediana de PFSc: 5.6 meses (IC del 95%, 3.9 – 7.0) con WELIREG vs. 5.6 meses (IC del 95%, 4.8 – 5.8) con everolimus.10
aBasado el modelo estratificado de riesgos proporcionales de Cox.
bBasado el primer análisis interino preespecificado.
cDel método de límite de producto (Kaplan – Meier) para datos censurados.
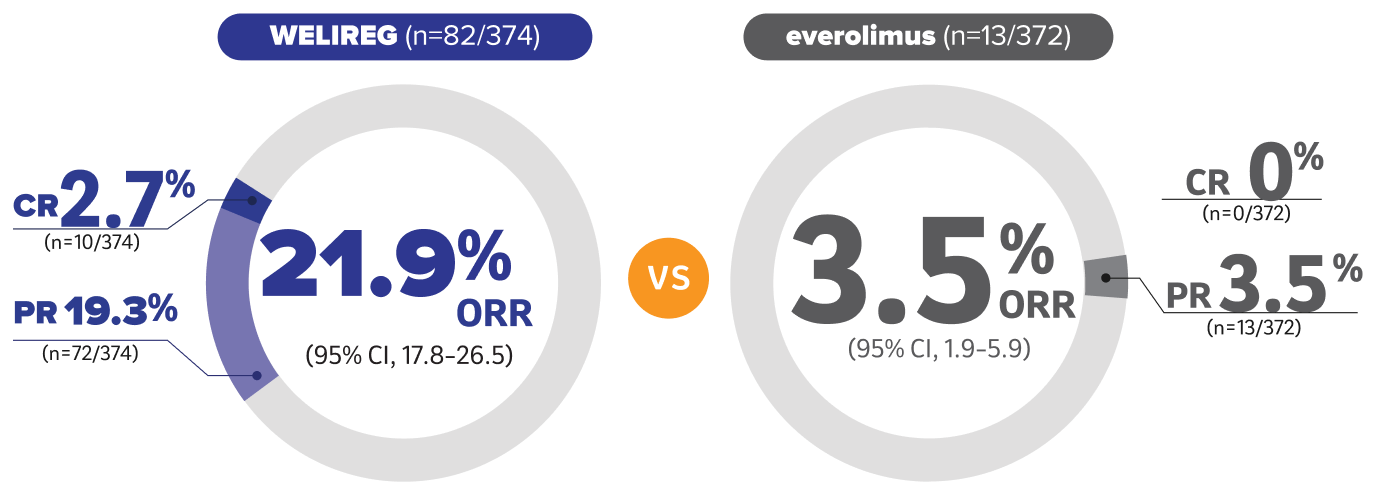
WELIREG demostró una ORR superior vs. everolimus en el primer análisis interino10
Los pacientes tratados con WELIREG alcanzaron una ORR del 21.9% vs. 3.5% de los pacientes que recibieron everolimus (P< 0.001)
-
No se alcanzó la mediana de DORC con WELIREG (intervalo: 1.7 + -23.2+ meses) comparado con 17.2 meses con everolimus (intervalo: 3.8 – 18.0 meses).12
- 74% de los pacientes que respondieron a WELIREG mantuvieron su respuesta durante más de 12 meses, en comparación con el 68% de aquellos tratados con everolimus.1
cDel método de límite de producto (Kaplan – Meier) para datos censurados.
Análisis final con una mediana de tiempo de seguimiento de 35.8 meses (intervalo: 26.9 – 49.2 meses)11
LIMITACIÓN: No se realizaron pruebas estadísticas para los análisis actualizados de PFS, ORR o DOR. No se pueden sacar conclusiones.
PFS actualizada11
- HR = 0.75 (IC del 95%, 0.63 – 0.88) con WELIREG vs. everolimus
- Eventos observados: 308 con WELIREG vs. 279 con everolimus.
- Mediana de PFS: 5.6 meses (IC del 95%, 3.8 – 6.5) con WELIREG vs. 5.6 meses (IC del 95%, 4.8 – 5.8) con everolimus.
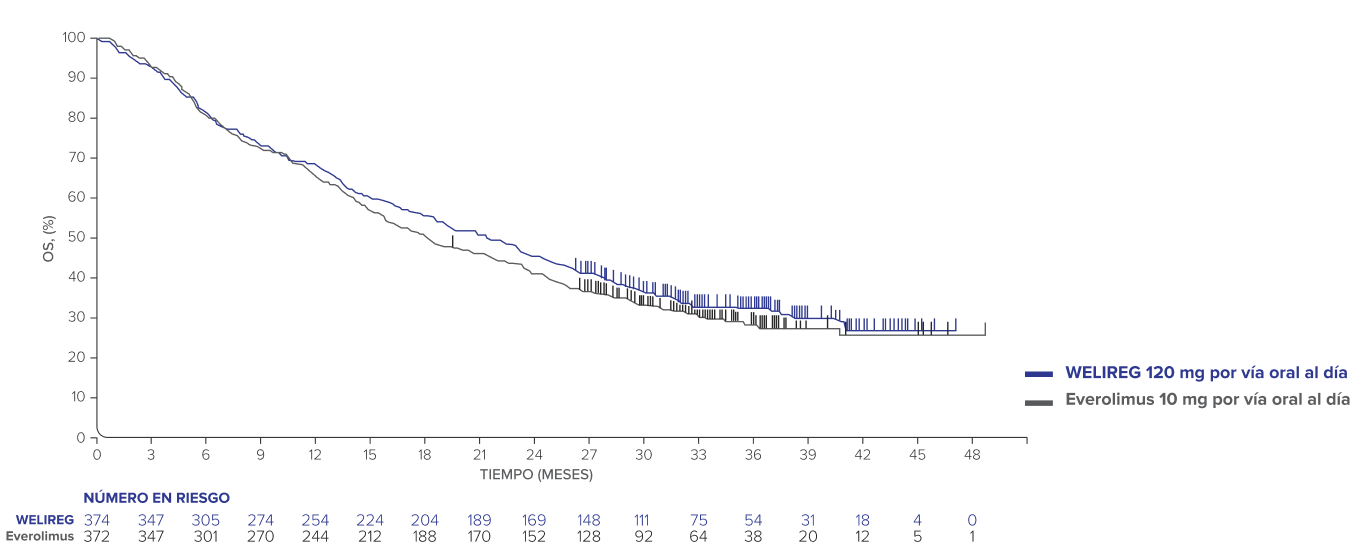
Supervivencia global (OS) 11
- La OS no alcanzó significancia estadística (HR = 0.92; IC del 95%, 0.77 – 1.10; P = 0.18).
- Eventos observados: 254/374 (67.9%) con WELIREG vs. 259/372 (69.6%) con everolimus.
- Mediana de OS: 21.4 meses (IC del 95%, 18.2 – 24.3) con WELIREG vs. 18.2 meses (IC del 95%, 15.8 – 21.8) con everolimus.
Estimaciones de Kaplan-Meier de la OS en el análisis final de LITESPARK-00511
ORR actualizado
-
22.7% (IC del 95%, 18.6 – 27.3) con WELIREG vs. 3.5% (IC del 95%, 1.9 – 5.9) con everolimus.
- La CR fue del 3.5% y la PR del 19.3% con WELIREG mientras que con everolimus, la CR fue del 0% y la PR del 3.5%
Estimaciones de Kaplan-Meier de la DOR en el análisis final de LITESPARK-00511
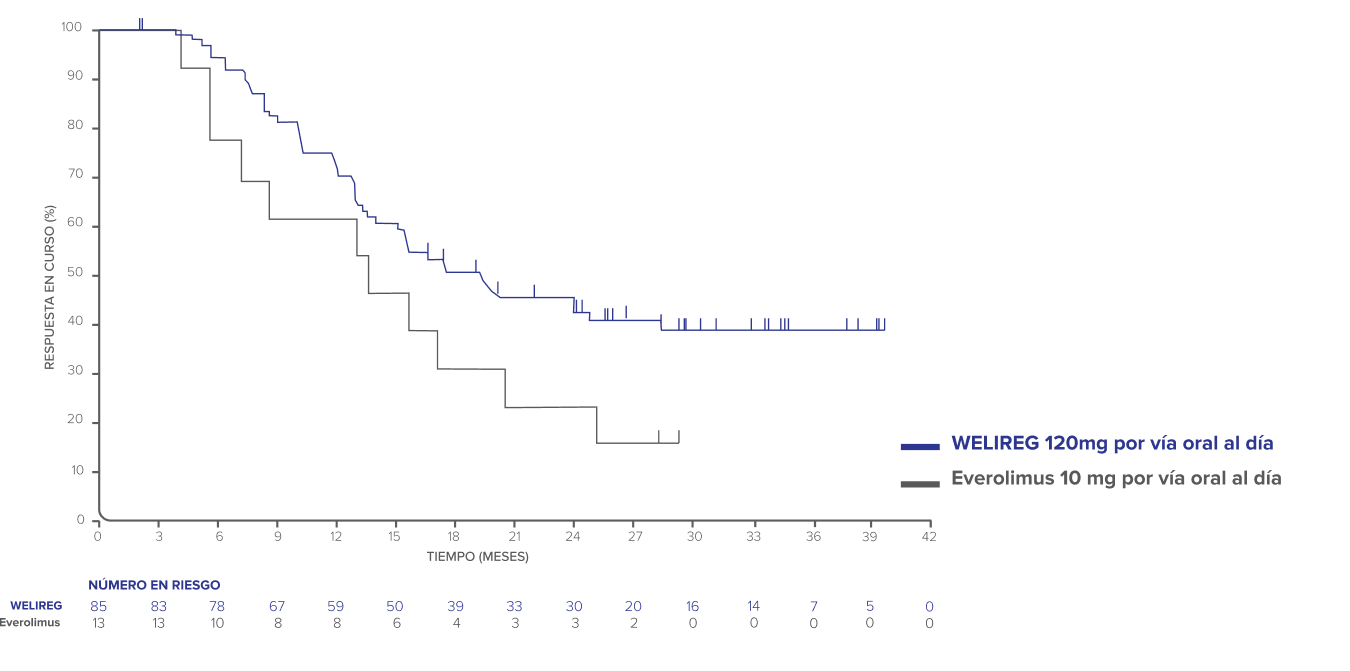
- Mediana de DOR: 19.3 (intervalo: 1.9 – 40.1+) con WELIREG vs. 13.7 (intervalo: 3.8 – 29.5+) con everolimus.
- Mediana de TTR: 3.8 meses (intervalo: 1.7 – 22.0) con WELIREG y 3.7 meses (intervalo: 1.8 – 5.7+) con everolimus.
Información Seleccionada de Seguridad
Hipoxia
- WELIREG puede causar hipoxia severa que puede requerir la discontinuación, oxígeno suplementario u hospitalización.
- Monitoree la saturación de oxígeno antes de iniciar, y periódicamente durante, el tratamiento. Para disminución de la saturación de oxígeno con ejercicio (por ejemplo, oxímetro de pulso <88% o PaO2 ≤55 mm Hg), considere suspender WELIREG hasta que la oximetría de pulso con ejercicio sea mayor del 88%, luego reanude a la misma o una dosis reducida. Para la disminución de la saturación de oxígeno en reposo (por ejemplo, oxímetro de pulso <88% o PaO2 ≤55 mm Hg) o cuando se indique una intervención urgente, suspenda WELIREG hasta que se resuelva y reanude a una dosis reducida o descontinúe. Para hipoxia sintomática recurrente o potencialmente mortal, descontinúe permanentemente WELIREG. Aconseje a los pacientes que informen los signos y síntomas de hipoxia inmediatamente a un profesional de la salud.
- En LITESPARK-005, la hipoxia ocurrió en el 15% de los pacientes y el 10% tuvo eventos de Grado 3. De los pacientes con hipoxia, el 69% fueron tratados con oxigenoterapia. El tiempo medio hasta la aparición de hipoxia fue de 30.5 días (rango: 1 día a 21.1 meses).
Abreviaturas:
2L: segunda línea; 3L: tercera línea; anti-PD-1/L1 = anti-PD-1 o anti-PD-L1; AR = reacción adversa; Cl = intervalo de confianza; CR = respuesta completa; CTLA-4: antígeno 4 asociado a linfocitos T citotóxicos; DOR = duración de la respuesta; ECOG PS = estado funcional del Grupo Oncológico Cooperativo de la Costa Oeste; HIF-1β = factor 1β inducible por hipoxia; HIF-2α = factor 2 alfa inducible por hipoxia; HR = razón de riesgo; IMDC = Consorcio Internacional de bases de datos metastásicos; ORR = respuesta objetiva global; OS = supervivencia global; PD-1 = receptor de muerte programada-1; PD-L1 = ligando del receptor de muerte programada 1; PFS = supervivencia libre de progresión; PR = respuesta parcial; RCC = carcinoma de células renales; RECIST v1.1 = Criterios de Evaluación de la Respuesta en Tumores Sólidos v1.1; TTR = tiempo hasta la respuesta; VEGF- TKI = inhibidor de la tirosina cinasa del factor de crecimiento endotelial vascular.
Referencias:
Referencias:
- Información para Prescribir de Welireg.
- Targeted drug therapy for kidney cancer. American Cancer Society, https://www.cancer.org/cancer/kidney-cancer/treating/ targeted-therapy.html. Consultado el 22 de marzo de 2024.
- Shenoy N, Pagliaro L. Sequential pathogenesis of metastatic VHL mutant clear cell renal cell carcinoma; putting it together with a translational perspective. Ann Oncol. 2016;27(9):1685-1695. doi: 10.1093/annonc/mdw241.
- Yap NY, Khoo WT, Perumal K, y cols. Practical updates in medical therapy for advanced and metastatic renal cell carcinoma. Urol Sci. 2018;29(3):120-128.
- Kaelin WG Jr. The VHL tumor suppressor gene: insights into oxygen sensing and cancer. Trans Am Clin Climatol Assoc. 2017;128:298-307.
- Correa AF, Rini Bl, Linehan WM y cols. Cancer of the kidney. In: DeVita VT Jr, Lawrence TS, Rosenberg SA, eds. Cancer: Principles and Practice of Oncology. 12th ed. Wolters Kluwer; 2022:729755.
- Kaelin WG Jr. HIF2 inhibitor joins the kidney cancer armamentarium. J Clin Oncol. 2018;36(9):908-910.
- Choi WSW, Boland J, Lin J. Hypoxia-inducible factor-2a as a novel target in renal cell carcinoma. J Kidney Cancer VHL. 2021;8(2):1-7. doi: 10.15586/jkcvhl.v8i1.170.
- Mattila KE, Vainio P, Jaakkola PM. Prognostic Factors for Localized Clear Cell Renal Cell Carcinoma and Their Application in Adjuvant Therapy. Cancers (Basel). 2022;14(1):239. doi: 10.3390/cancers14010239.
- Choueiri T.K., Powles T., Peltola K. y cols. Belzutifan versus Everolimus for Advanced Renal-Cell Carcinoma. N Engl J Med 2024; 391:710-21. DOI: 10.1056/NEJMoa2313906.
- Rini B, Suarez C, Albiges L, et al. Final analysis of the phase 3 LITESPARK-005 study of belzutifan versus everolimus in participants with previously treated advanced clear cell renal cell carcinoma. Diapositivas presentadas en: Congreso de la Sociedad Europea de Oncología Médica (ESMO); 13 – 17 de septiembre de 2024; Barcelona, España.
- Choueiri TK, Powles T, Peltola K, et al. Supplementary appendix to: Belzutifan versus everolimus for advanced renal-cell carcinoma. N Engl J Med. 2024;391(8):710- 721.
