
 Diseño de estudio
Diseño de estudio
Un estudio de fase 3 de KEYTRUDA® + cisplatino/5-FU vs. cisplatino /5-FU solo1
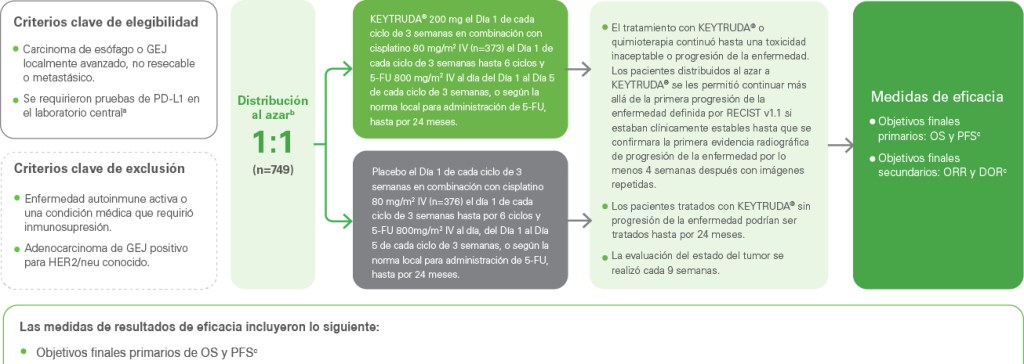
 Características del paciente
Características del paciente
Características iniciales de la población de pacientes.1

 Eficacia
Eficacia

 Reacciones adversas
Reacciones adversas
Reacciones adversas inmunomediadas reportadas con KEYTRUDA®
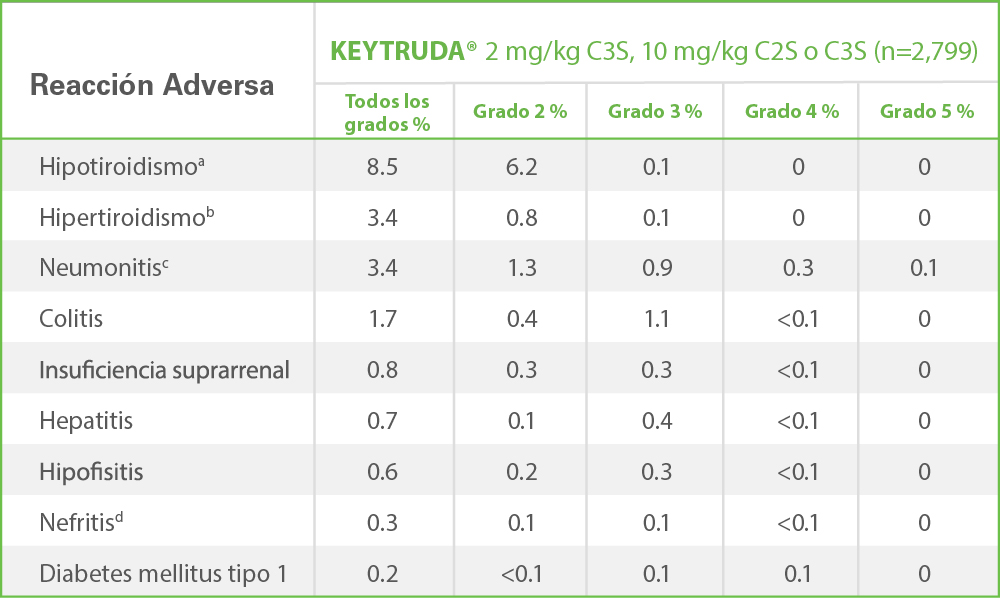
La tolerabilidad de KEYTRUDA® se evaluó en 2,799 pacientes en estudios controlados y no controlados. La mediana de duración del tratamiento fue de 4.2 meses (intervalo de 1 día a 30.4 meses), incluidos 1,153 pacientes tratados durante más de o igual a 6 meses y 600 pacientes tratados durante más de o igual a 1 año. KEYTRUDA® se suspendió por reacciones adversas relacionadas con el tratamiento en el 5% de los pacientes.
Los eventos adversos graves relacionados con el tratamiento (SAEs) se informaron hasta 90 días después de que se produjo la última dosis en el 10% de los pacientes que recibieron KEYTRUDA®. De estos (SAEs) relacionados con el tratamiento, los más comunes fueron neumonitis, colitis, diarrea y pirexia.1
a En estudios clínicos individuales de pacientes con HNSCC tratados con KEYTRUDA® como monoterapia (n = 909), la incidencia de hipotiroidismo fue del 16.1% (todos los grados) con 0.3% en Grado 3. En pacientes con HNSCC tratados con KEYTRUDA® en combinación con quimioterapia con platino y 5-FU (n = 276) la incidencia de hipotiroidismo fue del 15.2%, todos los cuales fueron de Grado 1 o 2. En pacientes con cHL (n=389) la incidencia de hipotiroidismo fue del 17% de los cuales fueron grado 1 o 2. En el estudio adyuvante de pacientes con RCC resecado tratados con KEYTRUDA® como monoterapia (n = 488), la incidencia de hipotiroidismo fue del 21% (todos los grados) con un 0.2% de grado 3.1
b En el estudio adyuvante de pacientes con RCC resecado tratados con KEYTRUDA® como monoterapia (n = 488), la incidencia de hipertiroidismo fue del 12% (todos los grados) con un 0.2% de grado 3.1
c En estudios clínicos individuales de pacientes con NSCLC tratados con KEYTRUDA® como monoterapia (total n = 2,022), la incidencia de neumonitis (todos los grados) varió de 3.8% a 8 .3 %. En pacientes con cHL tratados con KEYTRUDA® como monoterapia, la incidencia de neumonitis (todos los grados) el intervalo fue de 5.2% a 10.8% para los pacientes con cHL en el KEYNOTE-087 (n = 210) y KEYNOTE-204 (n = 148), respectivamente.1
d En pacientes con NSCLC no escamoso tratados con KEYTRUDA® 200 mg en combinación con quimioterapia con pemetrexed y platino (n = 405), la incidencia de nefritis fue del 1.7% (todos los grados) con 1.0% en grado 3 y 0.5% en grado 4.1
Reacciones adversas adicionales reportadas con KEYTRUDA®
 Información seleccionada de seguridad de KEYTRUDA®
Información seleccionada de seguridad de KEYTRUDA®
Para consultar la Información Seleccionada de Seguridad completa
REACCIONES ADVERSAS
Combo carcinoma esofágico
Cáncer esofágico Tratamiento de primera línea del cáncer de esófago/unión gastroesofágica localmente avanzado irresecable o metastásico KEYTRUDA se suspendió por reacciones adversas en el 15% de los pacientes. Las reacciones adversas más frecuentes que provocaron la discontinuación permanente de KEYTRUDA (≥1%) fueron neumonitis (1,6%), lesión renal aguda (1,1%) y neumonía (1,1%). Las reacciones adversas que llevaron a la interrupción de KEYTRUDA ocurrieron en el 67% de los pacientes. Las reacciones adversas más frecuentes que provocaron la interrupción de KEYTRUDA (≥2%) fueron neutropenia (19%), fatiga/astenia (8%), disminución del recuento de glóbulos blancos (5%), neumonía (5%), disminución del apetito (4,3%), anemia (3,2%), aumento de creatinina en sangre (3,2%), estomatitis (3,2%), malestar (3,0%), trombocitopenia (3%), neumonitis (2,7%), diarrea (2,4%), disfagia (2,2 %) y náuseas (2,2%). Cáncer esofágico metastásico o recurrente localmente avanzado previamente tratado Entre los 314 pacientes con cáncer de esófago enrolados en KEYNOTE-181 las reacciones adversas que ocurrieron fueron similares a las que sucedieron en los 2799 pacientes con melanoma o NSCLC tratados con KEYTRUDA como agente único.
Manejo de las reacciones adversas inmunomediadas
Si sospecha que su paciente está experimentando una reacción adversa inmunomediada al tratamiento con KEYTRUDA®, evalúe para confirmar la etiología o excluir otras causas. Según la gravedad de la reacción adversa, suspenda o interrumpa KEYTRUDA® y administre corticosteroides como se recomienda a continuación:1
 Referencia
Referencia
1. Kato K et al KEYNOTE-590 – ESMO 2020 LBAS_ PR ClinicalTrials.gov. https://clinicaltrials.gov/ct2/shows/NCT03189719
 Abreviaturas
Abreviaturas
Consulte la información seleccionada de seguridad haciendo
Escanea el código QR para acceder de forma directa a la información para prescribir


08/2023 AR-PDO-00011