Perfil de seguridad
Perfil de seguridad
Los siguientes datos reflejan la exposición a WINREVAIR en el estudio STELLAR. Los pacientes (n= 323) fueron aleatorizados en una proporción 1:1 para recibir WINREVAIR o placebo en combinación con las terapias de cuidado estándar. Los pacientes recibieron una dosis inicial de 0,3 mg/kg mediante inyección SC y la dosis se aumentó hasta la dosis objetivo de 0,7 mg/kg una vez cada 3 semanas durante 24 semanas. Después de completar la fase de tratamiento primario de 24 semanas, los pacientes continuaron en un período de tratamiento doble ciego a largo plazo (LTDB), manteniendo la asignación de tratamiento aleatorio, hasta que todos los pacientes completaron el período de tratamiento primario. La mediana de duración del tratamiento fue de 273 días en el grupo placebo y 313 días en el grupo WINREVAIR.
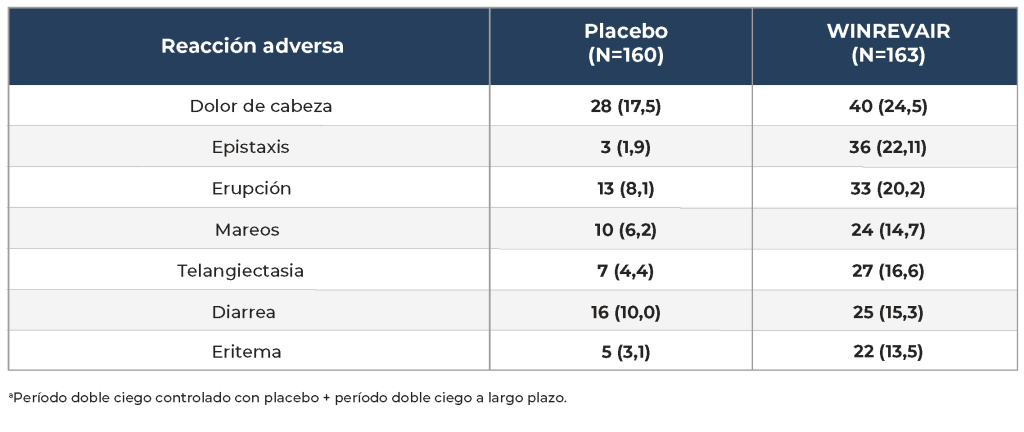
Las reacciones adversas más comunes que ocurren en STELLAR (≥10 % para WINREVAIR y al menos 5 % más que el placebo) se muestran a continuación.
Reacciones adversas ≥10% en pacientes que reciben WINREVAIR y al menos 5% más que placebo en STELLARa
Aumento de hemoglobina
- Los aumentos de Hb se controlaron mediante retraso en la dosis (10%), reducciones de dosis (6%) o ambas (5%).
- Se produjeron cambios en la Hb de niveles normales a niveles superiores a los normales en 87 (53%) pacientes que recibieron WINREVAIR y en 23 (14%) pacientes que recibieron placebo.
Trombocitopenia
- Las disminuciones de plaquetas se controlaron mediante retrasos en la dosis (2%), reducciones de dosis (2%) o ambos (2%).
- Se produjeron cambios en el recuento de plaquetas de normal a inferior a lo normal en 40 (25%) pacientes que recibieron WINREVAIR y en 26 (16%) pacientes que recibieron placebo.
Telangiectasia
En los pacientes expuestos a WINREVAIR que experimentaron telangiectasia, la mediana de tiempo hasta el inicio fue de 47,1 semanas.
Aumento de la presión arterial
En los pacientes que recibieron WINREVAIR, la presión arterial sistólica/diastólica media aumentó desde el inicio en 2,2/4,9 mmHg a las 24 semanas. En los pacientes que recibieron placebo, el cambio desde el inicio en la presión arterial media fue de -1,6/-0,6 mmHg.
Discontinuación del tratamiento
La incidencia general de discontinuaciones del tratamiento por reacciones adversas fue del 4% en el grupo con WINREVAIR y del 7% en el grupo con placebo. No hubo reacciones adversas específicas que causaran la discontinuación del tratamiento que ocurrieran con una frecuencia superior al 1% y con mayor frecuencia en el grupo con WINREVAIR.
Datos de seguridad a largo plazo
El perfil de seguridad en el período de extensión no controlado a largo plazo del estudio PULSAR fue en general similar al observado en el estudio STELLAR. Los pacientes fueron tratados con WINREVAIR 0,3 mg/kg o 0,7 mg/kg (n=104) y tuvieron una duración media de exposición de 151 semanas (máximo 218 semanas).
AR-SOT-00055