Calidad de vida

KEYTRUDA®
Calidad de vida relacionada con la salud en el KEYNOTE-048.2
- Los resultados de la calidad de vida relacionada con la salud (HRQoL) informados en la publicación fueron: los criterios de valoración secundarios y exploratorios preespecificados.2
- Los objetivos finales secundarios de HRQoL en el KEYNOTE-048 incluyeron:2
- Cambio medio desde el inicio en el cuestionario de calidad de vida Core 30 de la Organización Europea para la Investigación y el Tratamiento del Cáncer (EORTC QLQ-C3 0), puntuación del estado de salud global/calidad de vida (GHS/QoL). 2
- Tiempo hasta el deterioro (TTD) en la puntuación del EORTC QL Q-C30 GHS/QoL.2
- Puntuación de dolor y de la deglución del módulo específico de cáncer de cabeza y cuello de 35 preguntas de calidad de vida del EORTC (EORTC QLQH&N35).2
- El EORTC QLQ-C30 es un instrumento de HRQoL específico para el cáncer ampliamente utilizado, que cubre GHS y QoL, dominios funcionales importantes y síntomas generalizados asociados con el cáncer, como fatiga, dolor general y náuseas. El EORTC QLQ-H&N35 es un módulo específico para el cáncer de cabeza y cuello diseñado para usarse junto con el EORTC QLQ-C30 que considera l os síntomas relacionados con la enfermedad y el tratamiento de particular importancia para los pacientes con cáncer de cabeza y cuello, como el sitio-específico del dolor y la capacidad de deglutir.2
- Los datos de HRQoL se recopilaron al inicio del estudio; en las semanas 3, 6 y 9; durante cada 6 semanas hasta completar 1 año (51 semanas) o al final del tratamiento (lo que ocurra primero); y en la visita de seguimiento de tolerabilidad a los 30 días.2
- No hubo diferencias clínicamente significativas en las puntuaciones de EORTC QLQ-C30 GHS/QoL, funcionamiento y síntomas, para los pacientes que recibieron KEYTRUDA® en comparación con los que recibieron EXTREME o para los pacientes que recibieron KEYTRUDA ® + plat/5-FU en comparación con los que recibieron EXTREME. 2
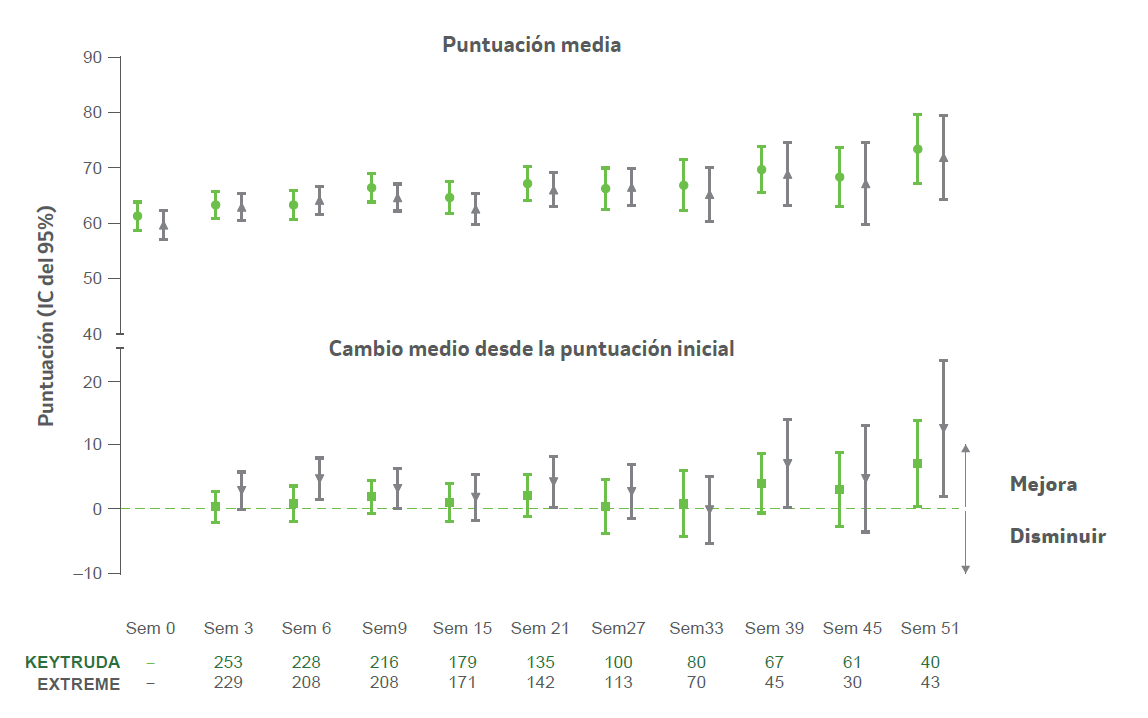
Puntuación del EORTC QLQ-C30 GHS/QoL para pacientes a lo largo del tiempo2
- KEYTRUDA® vs. EXTREME
- KEYTRUDA® plat/5-FU vs. EXTREME
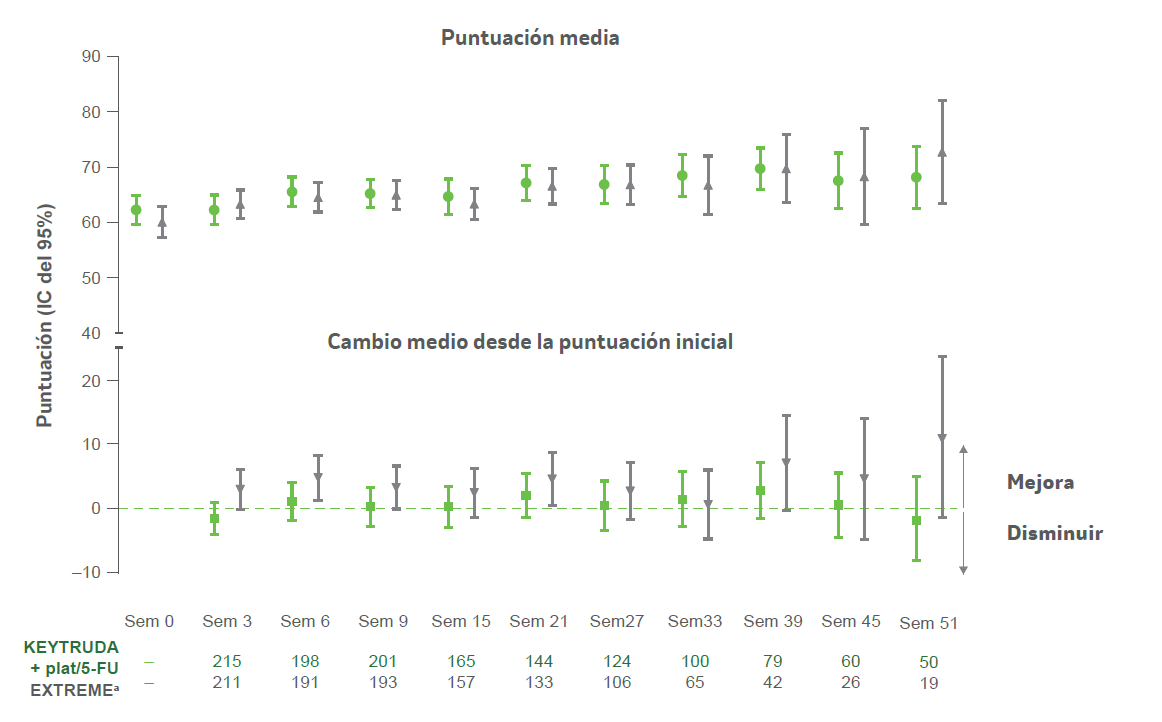
a Incluye solo participantes distribuidos al azar en el grupo EXT REME mientras que el grupo KEYTRUDA + plat/5-FU estaba abierto para la inscripción. Se calculó el cambio de la puntuación media desde el inicio a lo largo del tiempo entre los participantes con puntuaciones de GHS/QoL disponibles al inicio y en cada momento.2
- Los análisis descriptivos del cambio medio desde el inicio revelaron que las puntuaciones del EORTC QLQ-C30 GHS/QoL se mantuvieron estables en relación con el inicio en ca da momento hasta la semana 51. El análisis se extrajo de todos los grupos de tratamiento que estaban en el estudio y pudieron completar cuestionarios en momentos posteriores.2
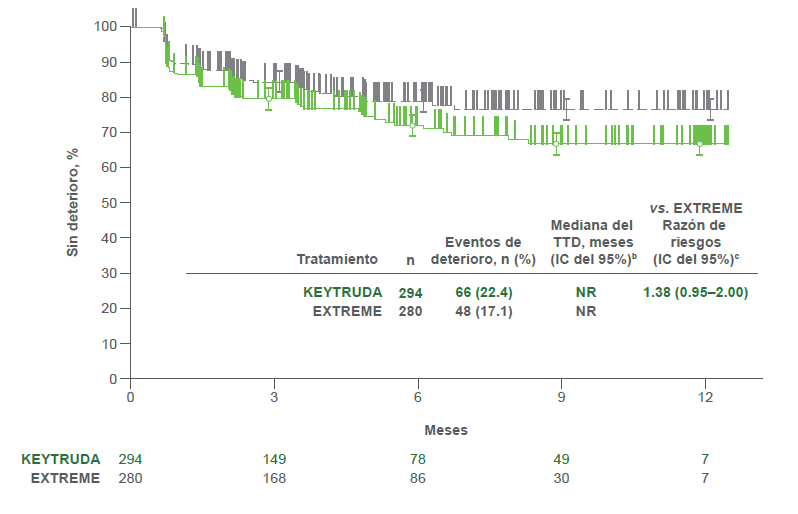
- El TTD en la puntuación del EORTC QLQ-C30 GHS/QoL fue similar tanto para los pacientes que recibieron KEYTRUDA® como para los que recibieron EXTREME (HR = 1.38; IC d el 95%, 0.95–2.00) y para los pacientes que recibieron KEYTRUDA® + plat/5-FU y los que recibieron EXTRE ME (HR=1.37; IC del 95%, 0.94–2.00).2
Estimados Kaplan-Meier de TTD por tratamiento en el GHS/QoL2
- KEYTRUDA® vs. EXTREME
- KEYTRUDA® plat/5-FU vs. EXTREME
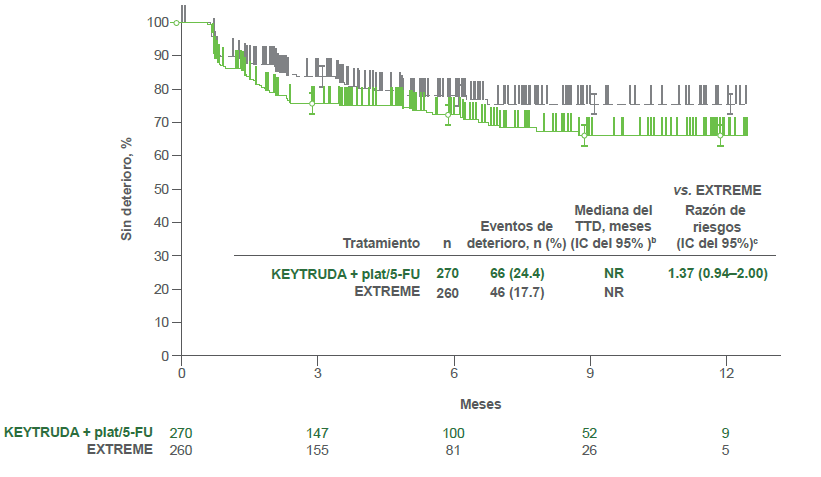
b Del método de límite de producto (Kaplan-Meier) para datos censurados.2
c Con base en el modelo de regresión de Cox con el método de Efron para el manejo de sucesos simultáneos como una covariable estratificada por ECOG PS (0 vs. 1), estado de VPH (positivo vs. negativo) y estado de PD-L1 (muy positivo vs. no muy positivo). 2
- Se observaron resultados similares del TTD en las puntuaciones de dolor y de la deglución del EORTC QLQ-H&N35 para ambas comparaciones de tratamientos.2
Estimados Kaplan-Meier de TTD por tratamiento en el EORTC QLQ-H &N352
Puntuación del dolor
- KEYTRUDA® vs. EXTREME
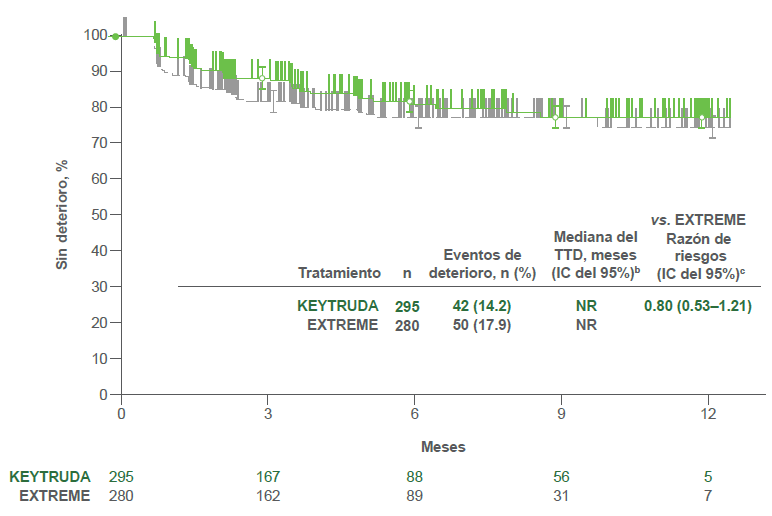
- KEYTRUDA® plat/5-FU vs. EXTREME
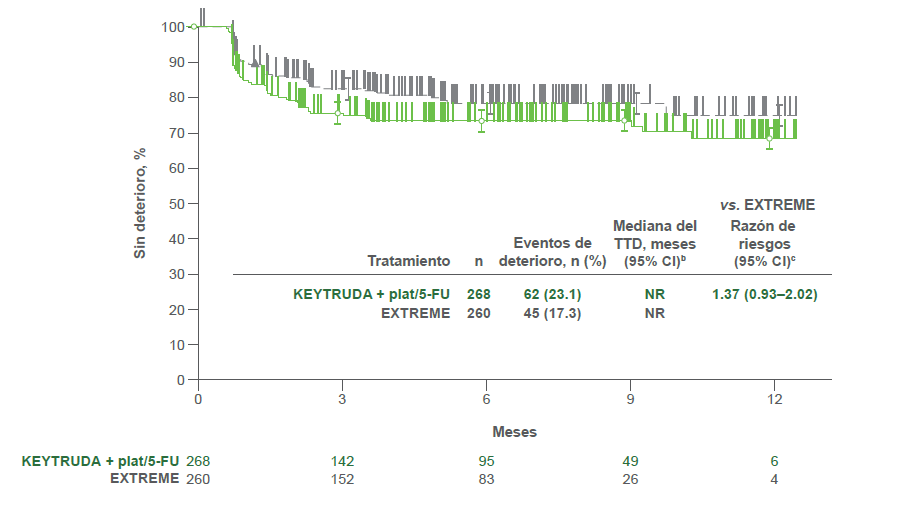
Estimados Kaplan-Meier de TTD por tratamiento en el EORTC QLQ-H &N352
Puntaje de la deglución
- KEYTRUDA® vs. EXTREME
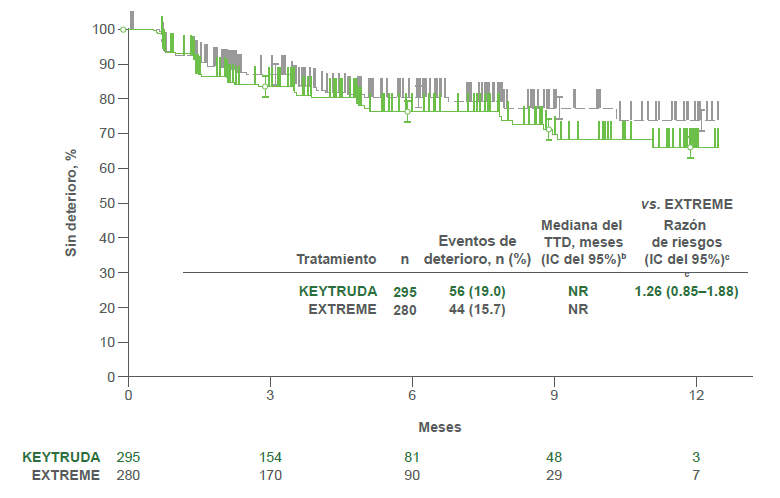
- KEYTRUDA® plat/5-FU vs. EXTREME
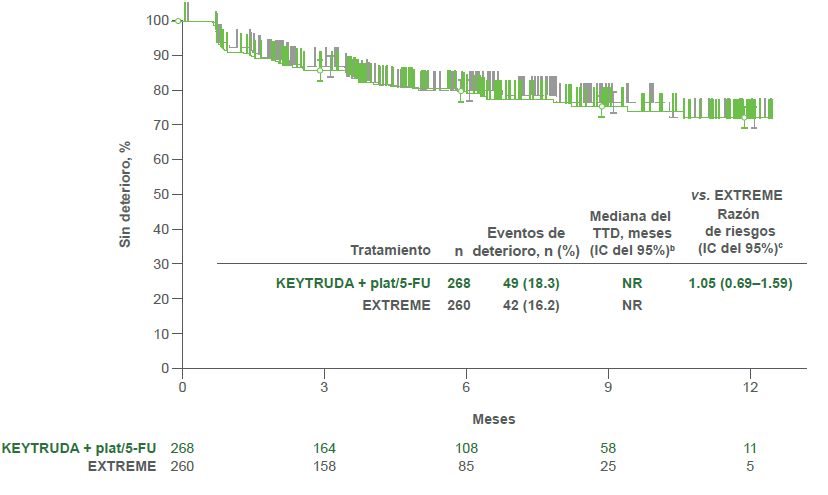
bDel método de límite de producto (Kaplan-Meier) para datos censurados.2
cCon base en el modelo de regresión de Cox con el método de Efron para el manejo de sucesos simultáneos como una covariable estratificada por ECOG PS (0 vs. 1), estado de VPH (positivo vs. negativo) y estado de PD-L1 (muy positivo vs. no muy positivo). 2

Información seleccionada de seguridad de KEYTRUDA®
ADVERTENCIAS Y PRECAUCIONES
Reacciones adversas inmunomediadas graves y mortales
Trastornos de la tiroides
KEYTRUDA puede causar trastornos inmunomediados de la tiroides. Se puede presentar tiroiditis con o sin endocrinopatía.
Después del hipertiroidismo puede presentarse hipotiroidismo. Inicie el reemplazo hormonal para el hipotiroidismo o instituir el tratamiento médico del hipertiroidismo según esté clínicamente indicado. Suspenda o interrumpa permanentemente KEYTRUDA según la gravedad. Se presentó tiroiditis en el 0.6% (16/2,799) de lo s pacientes que recibieron KEYTRUDA, incluido el grado 2 (0.3%) . Ninguno interrumpió, pero KEYTRUDA se suspendió en <0.1% (1) de los pacientes.
Se reportó hipertiroidismo en el 3.4% (96/2,799) de los pacientes que recibieron KEYTRUDA, incluidos los de Grado 3 (0.1%) y Grado 2 (0.8%). Lo que llevó a la interrupción permanente de KEYTRUDA e n <0.1% (2) y a la suspensión en el 0.3% (7) de los pacientes. Todos los pacientes a los que se les suspendió, reiniciaron KEYTRUDA después de la mejoría de los síntomas.
Se reportó hipotiroidismo en el 8% (237/2,799) de los pacientes que recibieron KEYTRUDA, incluidos los de Grado 3 (0.1%) y Grado 2 (6.2%). Lo que llevó a la interrupción permanente de KEYTRUDA e n <0.1% (1) y a la suspensión en el 0.5% (14) de los pacientes. Todos los pacientes a los que se les suspendió, reiniciaron KEYTRUDA después de la mejoría de los síntomas. La mayoría de los pacientes con hipotiroidismo requirió reemplazo de la hormona tiroidea a largo plazo. La incidencia de nueva presentación o empeoramiento del hipotiroidismo fue mayor en 1,185 pacientes con HNSCC, la cual se presentó en 16% de los pacientes que recibieron KEYTRUDA como agente único o en combinación con platino y FU, incluido hipotiroidismo de Grado 3 (0.3%).
Información Seleccionada de Seguridad completa – KEYTRUDA®
Abreviaturas:
ECOG PS = estado funcional del Grupo Oncológico Cooperativo del Este; EXTREME = cetuximab + platino + fluorouracilo; FU = fluorouracilo; HNSCC = carcinoma de células escamosas de cabeza y cuello; HR = razón de riesgos; IC = intervalo de confianza; NR = no alcanzado; PD-L1 = ligando 1 de muerte programada; plat /5-FU = platino/5-fluorouracilo; VPH = virus del papiloma humano .
Referencias:
- Información para prescribir de KEYTRUDA®.
- Rischin D, Harrington KJ, Greil R, y cols. Pembrolizumab alone or with chemotherapy for recurrent or met astatic head and neck squamous cell carcinoma: health-related quality-of-life results from KEYNOTE-048. Oral Oncol. 2022;128:105815. doi:10.1016/j.oraloncology.2022.105815.
09-23-LA-OHN-00024