Combo 1L: Caso Mario


Mario de 52 años refiere que siente dolor de garganta persistente con molestias al tragar y que notó la presencia de una hinchazón en el lado izquierdo de su cuello. Actualmente es fumador (25 paquetes de cigarrillos/año) y tiene un consumo de 8 o más bebidas alcohólicas por semana. Luego de la evaluación inicial se evidenció una masa de 4.9 cm. ubicada en la orofaringe lateral izquierda, con ganglios linfáticos aumentados de tamaño del mismo lado de hasta 3.2 cm.
EXAMEN INICIAL Y ESTUDIOS CLÍNICOS:
- Examen físico: Se encontró presencia de una masa orofaríngea lateral izquierda y ganglios linfáticos agrandados palpados en el cuello del lado izquierdo.
- Tomografías computarizadas:
- Se visualizó una masa de 4.9 cm. afectando la orofaringe lateral izquierda con invasión de las estructuras circundantes y encapsulamiento de la arteria carótida interna izquierda.
- Agrandamiento de los ganglios linfáticos cervicales ipsilaterales, siendo el más grande de 3.2 cm.
- Múltiples lesiones pulmonares bilaterales presentes.
- Biopsia central del ganglio linfático:
- Carcinoma de células escamosas (SCC) negativo a VPH, CPS = 10.
- Biopsia de pulmón:
- Se confirmó la presencia de metástasis a distancia,
ECOG PS = 1.
ESTADIFICACIÓN Y ANÁLISIS DE LA JUNTA MULTIDISCIPLINARIA PARA LA ATENCIÓN ONCOLÓGICA:
Carcinoma de células escamosas metastásico no resecable en orofaringe (estadio IVC). La junta multidisciplinaria para la atención oncológica determinó que la lesión era irresecable por la ubicación e invasión de estructuras locales.
¿Consideraría a Mario un paciente adecuado para el tratamiento con KEYTRUDA® (pembrolizumab)?
En el tratamiento de 1L del HNSCC metastásico o recurrente no resecable con CPS ≥1.1
Los datos de supervivencia global para KEYTRUDA® + plat/5-FU pueden ayudarlo a tomar decisiones importantes para sus pacientes con HNSCC metastásico o recurrente no resecable con expresión de PD-L1 (CPS ≥1).1
Análisis final del KEYNOTE-0481
Supervivencia global superior con KEYTRUDA® + plat/5-FU vs. EXTREME (CPS ≥1)a

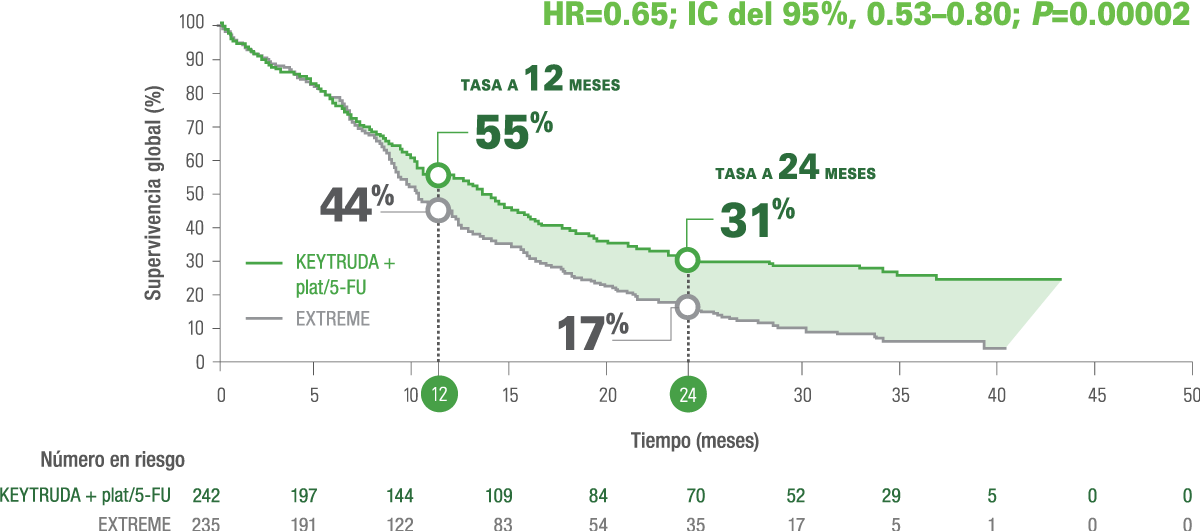
a Los pacientes que recibieron el régimen EXTREME recibieron cetuximab + carboplatino o cisplatino + 5-fluorouracilo.1
- La mediana de OS en pacientes adultos con CPS ≥1 tratados con KEYTRUDA® + plat/5-FU fue de 13.6 meses (IC del 95%, 10.7–15.5) vs. 10.4 meses (IC del 95%, 9.1–11.7) con EXTREME.1
- Reducción del 35% en el riesgo de muerte con KEYTRUDA® + plat/5-FU vs. EXTREME (HR=0.65; IC del 95%, 0.53–0.80; P=0.00002).1
- El número de eventos para OS fue de 177 (73%) con KEYTRUDA® + plat/5-FU y 213 (91%) con EXTREME.1
- La mediana de PFS fue de 5.1 meses (IC del 95%, 4.7–6.2) con KEYTRUDA® + plat/5-FU vs. 5.0 meses (IC del 95%, 4.8–6.0) con EXTREME (HR=0.84; IC del 95%, 0.69–1.02).1
- El número de eventos para PFS fue 212 (88%) con KEYTRUDA® + plat/5-FU y 221 (94%) con EXTREME.1
La HR de OS para el subgrupo de pacientes con PD-L1 CPS ≥20 para pembrolizumab + plat/5-FU vs. EXTREME fue de: HR 0.60 (IC del 95% 0.45-0.82) P=0.00044.1,3
KEYTRUDA® + plat/5-FU (CPS ≥1): ORR Y DOR1,a
La tasa de respuesta objetiva (ORR) fue del 36% (n=88/242) con KEYTRUDA® + plat/5-FU (CR=7%; PR=30%; IC del 95%) vs. 36% (n=84/235) con EXTREME (CR=3%; PR=33%; IC del 95%).1,b
La mediana de duración de la respuesta fue de 6.7 meses con KEYTRUDA® + plat/5-FU (intervalo: 1.6+ a 39.0+) vs. 4.3 meses con EXTREME (intervalo: 1.2+ a 31.5+).
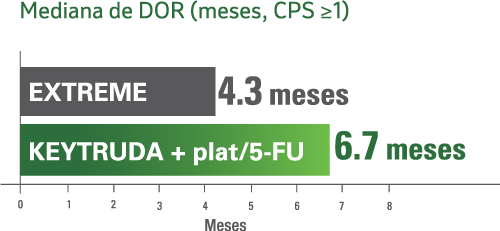
a Los pacientes que recibieron KEYTRUDA + plat/5-FU recibieron KEYTRUDA + carboplatino o cisplatino + 5-fluorouracilo.1
bLos pacientes que recibieron el régimen EXTREME recibieron cetuximab + carboplatino o cisplatino + 5-fluorouracilo.1

En el tratamiento de 1L del HNSCC metastásico o recurrente no resecable (CPS ≥1).1
Los datos de supervivencia global (OS) con KEYTRUDA® + plat/FU pueden ayudarle a tomar decisiones de tratamiento para sus pacientes adecuados.1,2
Análisis final del KEYNOTE-0481,3
Superviviencia global (OS) superior con KEYTRUDA® + plat/FU vs. EXTREME (CPS ≥1) en el KEYNOTE-048a
- Mediana de tiempo de seguimiento: 13.0 meses para KEYTRUDA® + plat/5-FU y 10.7 meses con EXTREME.1,3,b
- HR=0.65; (IC del 95%), 0.53–0.80; P=0.00002.c,d
- Eventos: 177/242 (73%) con KEYTRUDA® + plat/5-FU vs. 213/235 (91%) con EXTREME.a

PFS en el análisis final especificado por el protocolo1,b
- HR=0.84; (IC del 95%), 0.69–1.02.c
- Eventos: 212/242 (88%) con KEYTRUDA® + plat/FU vs. 221/235 (94%) con EXTREME.

aEXTREME = cetuximab + carboplatino o cisplatino + 5-fluorouracilo.1
b Fecha de corte de datos del análisis final: 25 de febrero de 201 9.3
cHR basado en el modelo de riesgo proporcional estratificado de Cox.1
dValor de P basado en una prueba estratificada de orden logarítmico.1
Análisis post hoc a 5 AÑOS del KEYNOTE-048
LIMITACIÓN: Después de la progresión de la enfermedad, los participantes del estudio KEYNOTE-048 podían recibir terapia posterior basado en la elección del investigador y se incluyeron en este análisis post hoc basado en una mediana de seguimiento extendida de 68.6 meses (intervalo: 61.2 – 82.1).e Este análisis post hoc fue de naturaleza exploratoria y se produjo después del análisis final específico del protocolo. No se planificó ninguna prueba estadística formal para este análisis y, por lo tanto, no se pueden sacar conclusiones.2
OS a 5 AÑOS con KEYTRUDA® + plat/FU vs. EXTREME (CPS ≥1) con una mediana de seguimiento de 68.6 meses.2,4,e

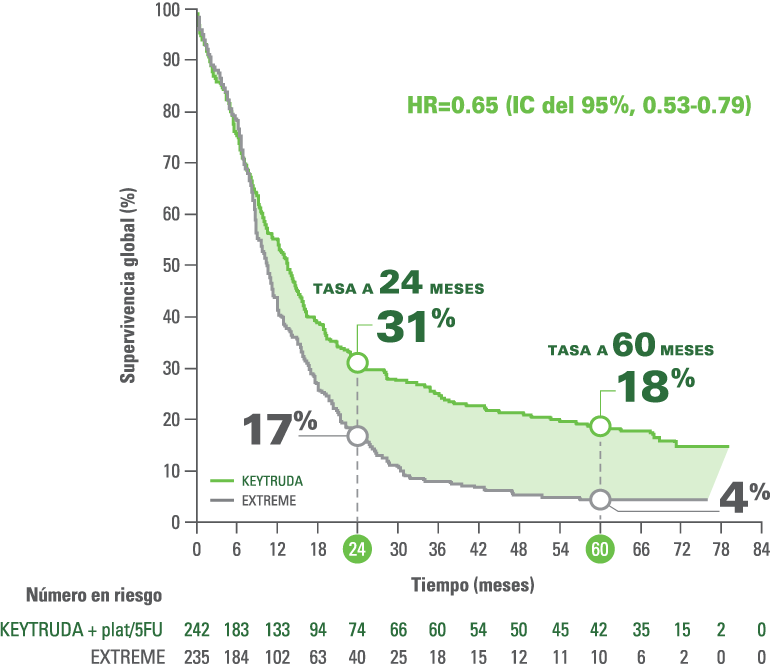
- Número de eventos 202/242 (83.5%) con KEYTRUDA® + plat/FU y 224/235 (95.3%) con EXTREME.4
- La mediana de OS fue de 13.6 meses (IC del 95%, 10.7-15.5) con KEYTRUDA® + plat/FU y 10.6 meses (IC del 95%, 9.1–11.7) con EXTREME.4
e Definido como el tiempo desde la distribución al azar hasta el corte de datos (21 de febrero de 2022). 2,4

Eventos adversos relacionados con el tratamiento con KEYTRUDA® + plat/FU vs. EXTREME en el KEYNOTE-048 5,a,b
Porcentaje de AE con KEYTRUDA® + plat/FU vs. EXTREME5
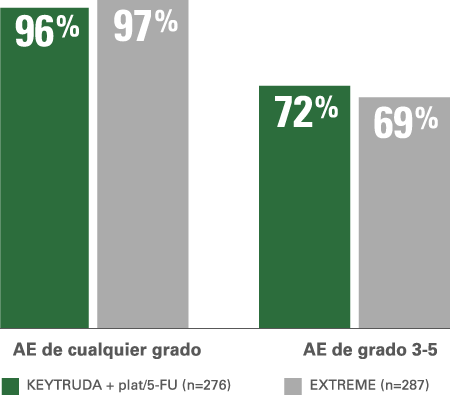
KEYTRUDA® + plat/FU vs. EXTREME:
AE relacionados al tratamiento con una incidencia ≥15%5
Población Total de Pacientes
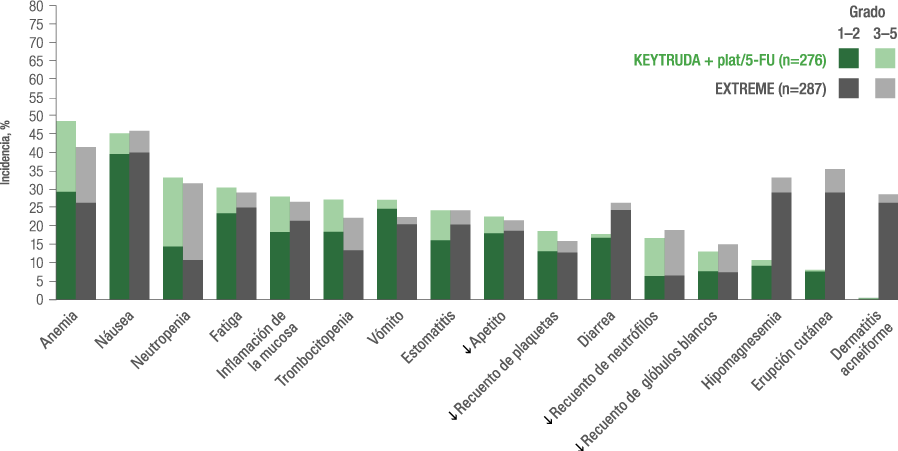
aLos pacientes que recibieron el régimen EXTREME recibieron cetuximab + carboplatino o cisplatino + 5-fluorouracilo.¹
bAE atribuidos al tratamiento del estudio por el médico en el análisis final.5
Tolerabilidad reportada en la información para prescribir1
Uso de pembrolizumab como tratamiento de 1L en pacientes con HNSCC.1
En general, se ha observado que la frecuencia de eventos adversos para pembrolizumab en combinación es más alta que la de pembrolizumab solo en monoterapia o quimioterapia, lo cual refleja la contribución de cada uno de estos componentes.1
Los médicos deben de considerar el balance en el riesgo/beneficio de las opciones de tratamiento disponibles (pembrolizumab en monoterapia o pembrolizumab en combinación con quimioterapia) antes de iniciar el tratamiento en pacientes con HNSCC cuyos tumores expresan PD-L1.1
Tolerabilidad reportada en el KN-048 a 5 años de seguimiento
Los datos de tolerabilidad presentados a 5 años de seguimiento del KN-048 fueron consistentes con los reportados en informes anteriores.3,6
Información seleccionada de seguridad de KEYTRUDA®
ADVERTENCIAS Y PRECAUCIONES
Reacciones adversas inmunomediadas graves y mortales
Dependiendo de la gravedad de la reacción adversa inmunomediada, suspenda o interrumpa permanentemente KEYTRUDA. En general, si KEYTRUDA requiere la suspensión o interrupción, administre tratamiento con corticosteroides sistémicos (1 a 2 mg/kg/día de prednisona o equivalente) hasta que mejore a Grado 1 o menos. Después de mejorar a Grado 1 o menos, inicie la disminución gradual de los corticosteroides y continúe disminuyendo durante al menos 1 mes. En pacientes cuyas reacciones adversas inmunomediadas no pudieron controlarse con corticosteroides, puede considerarse la administración de otros inmunosupresores sistémicos.
Información Seleccionada de Seguridad completa – KEYTRUDA®
Abreviaturas:
1L = primera línea; AE = eventos adversos ; CPS = escala combinada positiva; CR = respuesta completa; DOR = duración de la respuesta;
ECOG PS = estado funcional del Grupo Oncológico Cooperativo del Este; HNSCC = carcinoma de células escamosas de cabeza y cuello; HR = razón de riesgos; IC = intervalo de confianza; KN = KEYNOTE ; ORR = tasa de respuesta objetiva; OS = supervivencia global; PD-L1 = ligando 1 de muerte programada; PFS = supervivencia lib re de progresión; plat/5-FU = platino + 5-fluorouracilo; PR = respuesta parcial; VPH = virus del papiloma humano.
Referencias:
- Información para prescribir de KEYTRUDA®.
- Tahara M, Greil R, Rischin D y cols. Pembrolizumab with or without chemotherapy for first-line treatment of recurrent/metastatic (R/M) head and neck squamous cell carcinoma (HNSCC): 5 -year re sults from KEYNOTE-048. Abstract. Annals of Oncology. 2022; 33 (suppl_7): S295-S322. 10.1016/annonc/annonc1056.
- Burtness B, Harrington KJ, Greil R, y cols., para los investigadores de KEYNOTE-048. Pembrolizumab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (KEYNOTE-048): a randomised, open-label, phase 3 study. Lancet. 2019;394:1915-28.
- Datos en archivo, MSD.
- Burtness B, Harrington KJ, Greil R, y cols. Apéndice suplementario de: Pembrolizumab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (KEYNOTE-048): a randomised, open-label, phase 3 study. Lancet. 2019;1-11. doi:10.1016/S0140-6736(19)32591-7.
- Tahara M, Greil R, Rischin D y cols. Pembrolizumab with or without chemotherapy for first-line treatment of recurrent/metastatic head and neck squamous cell carcinoma: 5-year results from KEYNOTE-048. Presentación oral presentada en el congreso de la European Society for Medical Oncology (ESMO 2022).
09-23-LA-OHN-00024