Mono 1L : Caso Verónica


Verónica de 65 años, siente desde hace 3 meses dolor al mastica r y bebe 8 o más bebidas alcohólicas cada semana. Ha recibido hace 18 meses un diagnóstico de carcin oma de células escamosas (SCC) en la cavidad oral en estadio III con una prueba negativa a VPH. Luego del diagnóstico fue sometida a resección en bloque del tumor primario y disección de ganglios linfáticos ipsilaterales en el que se lograron márgenes claros, posterior a la cirugía recibió radioterapia.
Actualmente los exámenes de Verónica demuestran:
EN UNA TOMOGRAFÍA COMPUTARIZADA
- Masa en cavidad oral de 2.8 cm sospechosa de recurrencia locorregional con invasión muscular extensa y erosión a través del hueso cortical del maxilar.
- Ganglio linfático cervical agrandado de 2 cm sin evidencia radiológica de extensión extraganglionar.
POR SU PARTE, LOS HALLAZGOS ADICIONALES Y ESTADIFICACIÓN FUERON:
Biopsia central del ganglio linfático:
- SCC negativo para VPH recurrente CPS = 26, ECOG PS = 0.
Estadificación y análisis del equipo multidisciplinario:
- SCC de cavidad oral recurrente (estadio IVA).
- Determinación por parte del equipo multidisciplinario para la atención oncológica de que la lesión era no resecable debido a la ubicación e invasión de estructuras locales.
Consideraría a Verónica una paciente adecuada para el tratamiento con KEYTRUDA® (pembrolizumab)?
Para el tratamiento en 1L del HNSCC metastásico o recurrente no resecable con CPS ≥1.1
Los datos de supervivencia global para la monoterapia de KEYTRUDA® pueden ayudarle a tomar decisiones importantes para sus pacientes con HNSCC metastásico o recurrente no resecable con expresión de PD-L1 (CPS ≥1) 1
Análisis final del KN-048
OS superior con KEYTRUDA® en monoterapia vs. EXTREME (CPS ≥1)1,a
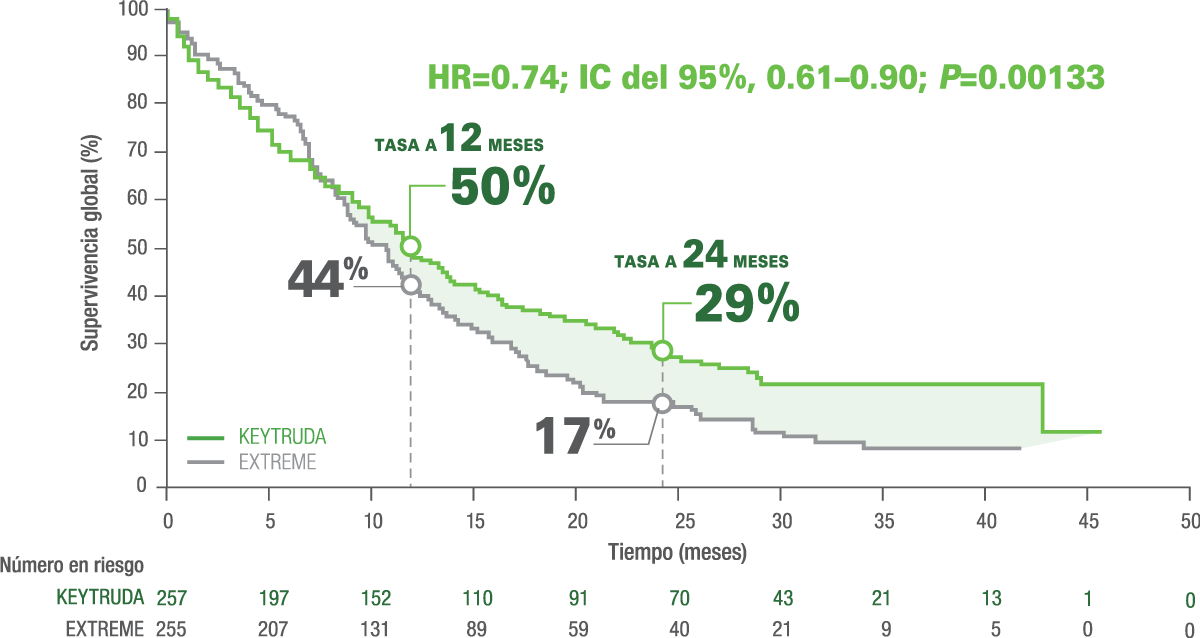
a Los pacientes que recibieron el régimen EXTREME recibieron cetuximab + carboplatino o cisplatino + 5-fluorouracilo.1
- La mediana de OS en pacientes adultos con CPS ≥1 tratados con KEYTRUDA® fue de 12.3 meses (IC del 95%, 10.8–14.9) vs. 10.3 meses (IC del 95%, 9.0–11.5) con EXTREME. 1
- Reducción del 26% en el riesgo de muerte con KEYTRUDA® vs. EXTREME (HR=0.74; IC del 95%, 0.61–0.90; P=0.00133).1
- El número de eventos para OS fue 197 (77%) con KEYTRUDA® y 229 (90%) con EXTREME. 1
- La mediana de PFS fue de 3.2 meses (IC del 95%, 2.2–3.4) con KEYTRUDA® vs. 5.0 meses (IC del 95%, 4.8–6.0) con EXTREME (HR=1.13; IC del 95%, 0.94–1.36). 1
- El número de eventos para PFS fue 228 (89%) con KEYTRUDA® y 237 (93%) con EXTREME. 1
- La ORR fue de 19.1% con KEYTRUDA® vs. 35% con EXTREME. 1
- La mediana de DOR fue de 23.4 meses (intervalo: 1.5+ – 43.0+) con KEYTRUDA® vs. 4.5 meses (intervalo:
1.2+–38.7+) con EXTREME. 1
KEYTRUDA® (pembrolizumab), como monoterapia o en combinación co n quimioterapia con platino y 5-fluorouracilo (5-FU), está indicado para el tratamiento en pri mera línea del carcinoma de células escamosas de cabeza y cuello (HNSCC) metastásico o recurrente no resecabl e en adultos cuyos tumores expresan PD-L1 con una CPS ≥ 1.¹
OS: KEYTRUDA® como monoterapia (CPS ≥20) vs. EXTREME 1
KEYTRUDA® como monoterapia: OS superior en pacientes adultos con expresión de PD-L1 (CPS ≥20) vs. EXTREME.1,a
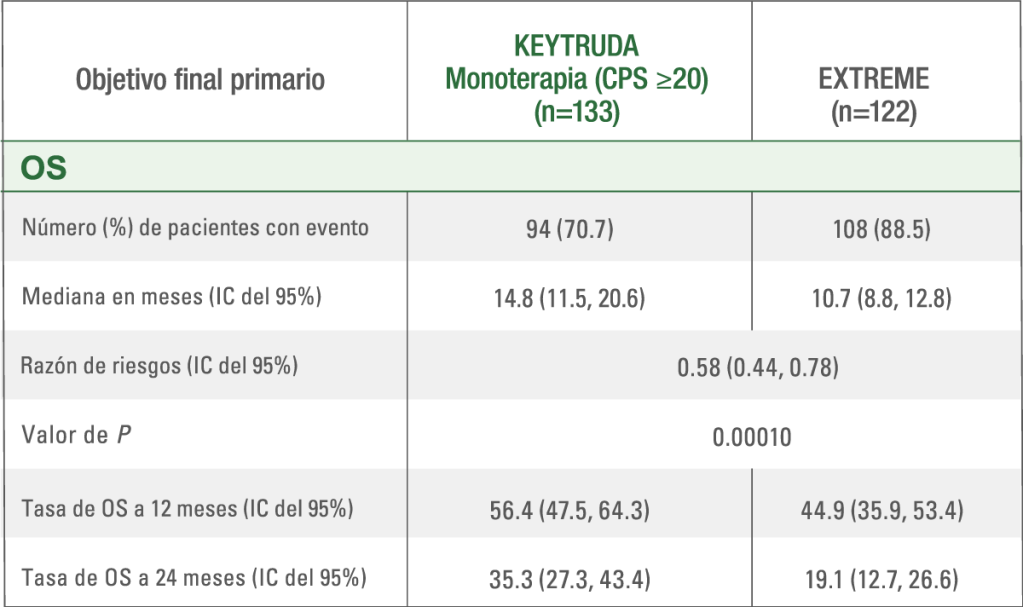
a Los pacientes que recibieron el régimen EXTREME recibieron cetuximab + carboplatino o cisplatino + 5-fluorouracilo. 1
- La mediana de OS en pacientes adultos con CPS ≥20 tratados con monoterapia con KEYTRUDA® fue de 14.8 meses (IC del 95%, 11.5–20.6) vs. 10.7 meses (IC del 95%, 8.8–12.8) con EXTREME. 1
- La mediana de PFS fue de 3.4 meses (IC del 95%, 3.2–3.8) con KEYTRUDA® vs. 5.3 meses (IC del 95%, 4.8–6.3) con EXTREME (HR=0.99; IC del 95%, 0.76–1.29 ; P=0.4679).1
ORR y DOR: KEYTRUDA® como monoterapia (CPS ≥20) vs. EXTREME1
Tasa de respuesta objetiva (CPS ≥20)
La tasa de respuesta objetiva en pacientes con una CPS ≥20 fue del 23.3% con KEYTRUDA® (n=31/133) vs. 36.1% con EXTREME (n=44/122). 1,b
Mediana de DOR (meses, CPS ≥20)
La mediana de duración de la respuesta fue de 22.6 meses con KEYTRUDA® (2.7+ a 43.0+) vs. 4.2 meses con EXTREME (1.2+ a 31.5+)
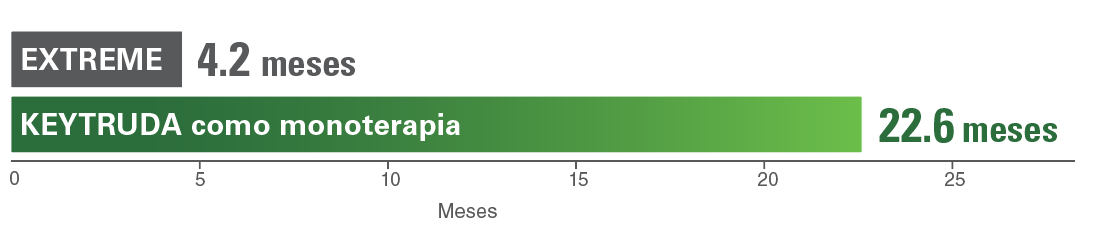
b Los pacientes que recibieron el régimen EXTREME recibieron cetuximab + carboplatino o cisplatino + 5-fluorouracilo. 1
En el tratamiento de 1L del HNSCC metastásico o recurrente no resecable (CPS ≥1).1
Los datos de supervivencia global (OS) con KEYTRUDA® como monoterapia pueden ayudarle a tomar decisiones de tratamiento para sus pacientes adecuados.1,2
Análisis final del KEYNOTE-0481
OS superior con KEYTRUDA® como monoterapia vs. EXTREME (CPS ≥1)a
- Mediana de tiempo de seguimiento: 11.5 meses para KEYTRUDA®.1,3,b
- HR=0.74; (IC del 95%), 0.61–0.90; P=0.00133.c,d
- Eventos: 197/257 (77%) con KEYTRUDA® vs. 229/255 (90%) con EXTREME.a

PFS en el análisis final especificado por el protocolob
- HR=1.13; (IC del 95%, 0.94–1.36).c
- Eventos: 228/257 (89%) con KEYTRUDA® vs. 237/255 (93%) con EXTREME.

aEXTREME = cetuximab + carboplatino o cisplatino + 5-fluorouracilo.1
b Fecha de corte de datos del análisis final: 25 de febrero de 201 9.3
cHR basado en el modelo de riesgo proporcional estratificado de Cox.
dValor de P basado en una prueba estratificada de orden logarítmico.
Análisis post hoc a 5 AÑOS del KEYNOTE-048
LIMITACIÓN: Después de la progresión de la enfermedad, los participantes del estudio KEYNOTE-048 podían recibir terapia posterior basado en la elección del investigador y se incluyeron en este análisis post hoc basado en una mediana de seguimiento extendida de 69.2 meses (intervalo: 61.2-81.6). Este análisis post hoc fue de naturaleza exploratoria y se produjo después del análisis final específico del protocolo. No se planificó ninguna prueba estadística formal para este análisis y, por lo tanto, no se pueden sacar conclusiones.2
OS a 5 AÑOS con KEYTRUDA® como monoterapia vs. EXTREME (CPS ≥1) con una mediana de seguimiento de 69.2 meses.2,4,a

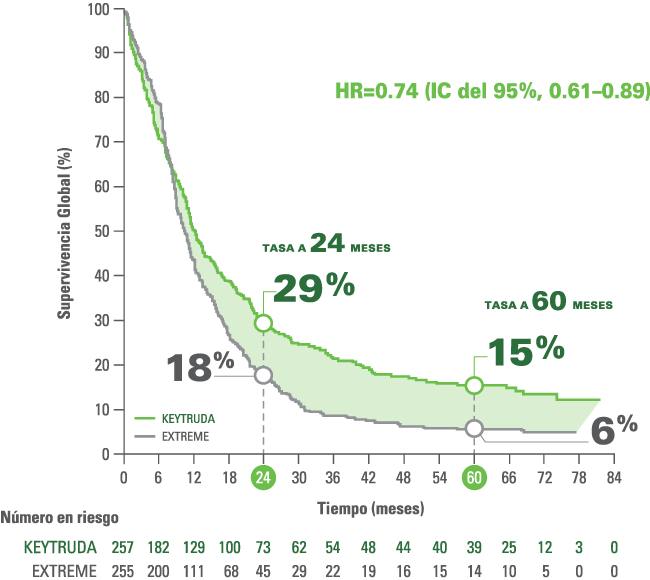
- Eventos: 220/257 (85.6%) con KEYTRUDA® y 241/255 (94.5%) con EXTREME.4
- La mediana de OS fue de 12.3 meses (IC del 95%, 10.8-14.8) con KEYTRUDA® y 10.4 meses (IC del 95%, 9.0–11.7) con EXTREME.4
e Definido como el tiempo desde la distribución al azar hasta el corte de datos (21 de febrero de 2022). 2,4

Eventos adversos relacionados con el tratamiento con KEYTRUDA® como monoterapia vs. EXTREME en el KEYNOTE-048 5,a,b
Porcentaje de AE con KEYTRUDA® en monoterapia vs. EXTREME5
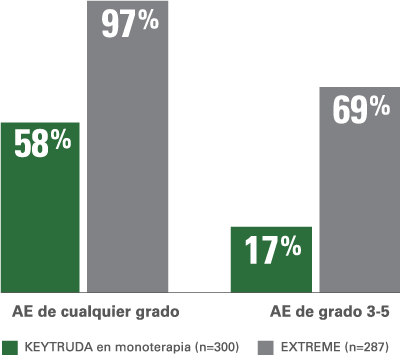
KEYTRUDA® en monoterapia vs. EXTREME:
AE relacionados al tratamiento con una incidencia ≥15%5
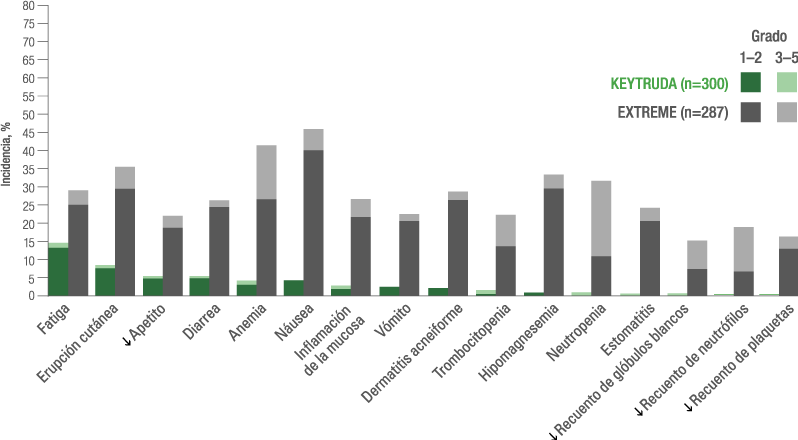
aLos pacientes que recibieron el régimen EXTREME recibieron cetuximab + carboplatino o cisplatino + 5-fluorouracilo.¹
bAE atribuidos al tratamiento del estudio por el médico en el análisis final.5
Tolerabilidad reportada en la información para prescribir1
Uso de pembrolizumab como tratamiento de 1L en pacientes con HNSCC .1
En general, se ha observado que la frecuencia de eventos adversos para pembrolizumab en combinación es más alta que la de pembrolizumab solo en monoterapia o quimioterapia, lo cual refleja la contribución de cada uno de estos componentes.1
Los médicos deben de considerar el balance en el riesgo/beneficio de las opciones de tratamiento disponibles (pembrolizumab en monoterapia o pembrolizumab en combinación con quimioterapia) antes de iniciar el tratamiento en pacientes con HNSCC cuyos tumores expresan PD-L1.1
Tolerabilidad reportada en el KN-048 a 5 años de seguimiento
Los datos de tolerabilidad presentados a 5 años de seguimiento del KN-048 fueron consistentes con los reportados en informes anteriores.3,6
Información seleccionada de seguridad de KEYTRUDA®
ADVERTENCIAS Y PRECAUCIONES
Reacciones adversas inmunomediadas graves y mortales
Vigile de cerca a los pacientes para detectar síntomas y signos que puedan ser manifestaciones clínicas de reacciones adversas inmunomediadas subyacentes. La identificación y el manejo tempranos son esenciales para garantizar el uso seguro de los tratamientos anti-PD-1/PD-L1. Evalúe las enzimas hepáticas, la creatinina y la función tiroidea al inicio y periódicamente durante el tratamiento. En los casos de sospecha de reacciones adversas inmunomediadas, inicie un análisis adecuado para excluir etiologías alternativas, incluida la infección. Instituir el manejo médico de inmediato, incluida la consulta especializada, según corresponda.
Información Seleccionada de Seguridad completa – KEYTRUDA®
Abreviaturas:
1L = primera línea; AE = eventos adversos ; CPS = escala combinada positiva; DOR = duración de la respuesta; ECOG PS = estado funcional del Grupo Oncológico Cooperativo del Este; HNSCC = carcinoma de células escamosas de cabeza y cuello; HR = razón de riesgos; IC = intervalo de confianza; KN = KEYNOTE; OS = supervivencia global; PD-1= receptor de muerte programada 1; PD-L1 = ligando 1 de muerte programada; PFS = supervivencia libre de progresión; ORR= tasa de respuesta objetiva; VPH = virus del papiloma humano.
Referencias:
- Información para prescribir de KEYTRUDA®.
- Tahara M, Greil R, Rischin D y cols. Pembrolizumab with or without chemotherapy for first-line treatment of recurrent/metastatic (R/M) head and neck squamous cell carcinoma (HNSCC): 5 -year results from KEYNOTE-048. Abstract. Annals of Oncology. 2022; 33 (suppl_7): S295-S322. 10.1016/annonc/annonc1056.
- Burtness B, Harrington KJ, Greil R, y cols., para los investigadores de KEYNOTE-048. Pembrolizumab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (KEYNOTE-048): a randomised, open-label, phase 3 study. Lancet. 2019;394:1915-28.
- Datos en archivo, MSD.
- Burtness B, Harrington KJ, Greil R, y cols. Apéndice suplementario de: Pembrolizumab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (KEYNOTE-048): a randomised, open-label, phase 3 study. Lancet. 2019;1-11. doi:10.1016/S0140-6736(19)32591-7.
- Tahara M, Greil R, Rischin D y cols. Pembrolizumab with or without chemotherapy for first-line treatment of recurrent/metastatic head and neck squamous cell carcinoma: 5-year results from KEYNOTE-048. Presentación oral presentada en el congreso de la European Society for Medical Oncology (ESMO 2022).
09-23-LA-OHN-00024