Reacciones Adversas

REACCIONES ADVERSAS INMUNO-RELACIONADAS REPORTADAS CON KEYTRUDA® (pembrolizumab)1
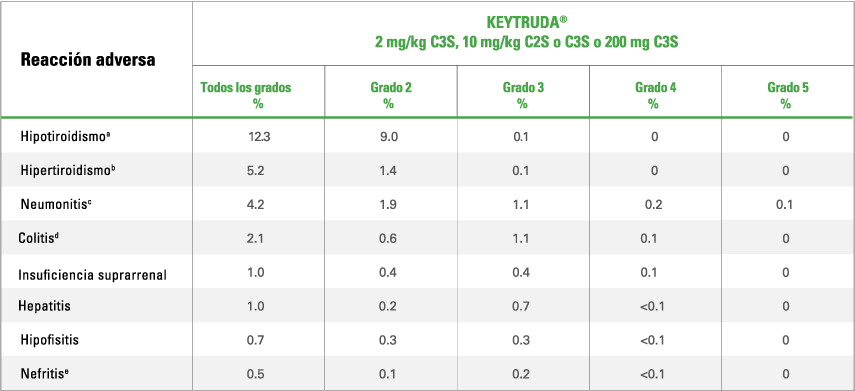
a En pacientes con HNSCC tratados con pembrolizumab como monoterapia (n=909), la incidencia de hipotiroidismo fue de 16.1% (en todos los grados) con un 0.3% de Grado 3. En pacientes con HNSCC tratados con pembrolizumab en combinación con quimioterapia con platino y 5-FU (n=276), la incidencia de hipotiroidismo fue del 15.2%, todos de los cuales fueron de grado 1 o 2. En pacientes tratados con pembrolizumab en combinación con axitinib o lenvatinib (n=1,456), la incidencia de hipotiroidismo fue de 46.2% (en t odos los grados) con 0.8% de grado 3 o 4. En pacientes con RCC y melanoma tratados con monoterapia con pembrolizumab en tratamiento adyuvante (n=1,480), la incidencia de hipotiroidismo fue de 17.7%, la mayoría de los cuales fuer on de grado 1 o 2.
b En pacientes con RCC y melanoma tratados con monoterapia con pembrolizumab en el entorno adyuvante (n=1,480), la incidencia de hipertiroidismo fue de 10.9%, la mayoría de los cuales fueron de grado 1 o 2.
c En pacientes con NSCLC, ocurrió neumonitis en 160 (5.7%), incluidos casos de grado 2, 3, 4 o 5 en 62 (2.2%), 47 (1.7%), 14 (0 .5%) y 10 (0.4%), respectivamente. En los pacientes con NSCLC, ocurrió neumonitis en el 8.9% de los pacientes con antecedentes de radiación torácica previa. En pacientes con cHL, la incidencia de neumonitis (todos los grados) osciló entre 5.2% y 10.8% para los pacientes con cHL en KEYNOTE-087 (n=210) y KEYNOTE-204 (n=148), respectivamente.
d En pacientes con CRC tratados con pembrolizumab como monoterapia (n=153), la incidencia de colitis fue de 6.5% (en todos los grados) con 2.0% en grado 3 y 1.3 % en grado 4.
e En pacientes con NSCLC no escamoso tratados con pembrolizumab en combinación con pemetr exed y quimioterapia con platino (n=488), la incidencia de nefritis fue del 1.4% (t odos los grados), con un 0.8% de grado 3 y un 0.4% de grado 4.

- Se han producido reacciones adversas inmuno-relacionadas, incluidos casos graves y mortales, en pacientes que recibieron KEYTRUDA®. La mayoría de las reacciones adversas inmuno-relacionadas durante el tratamiento fueron reversibles y se manejaron con interrupciones de KEYTRUDA®, la administración de corticosteroides y / o cuidados de soporte. También se han producido reacciones adversas inmuno-relacionadas después de la última dosis de pembrolizumab. Pueden ocurrir de manera simultánea reacciones adversas inmuno-relacionadas que afecten a más de un sistema corporal.1
- Para las sospechas de reacciones adversas inmuno-relacionadas, se debe garantizar una evaluación adecuada para confirmar la etiología o excluir otras causas. Según la gravedad de la reacción adversa, se debe suspender el pembrolizumab y administrar corticosteroides. Tras la mejora a grado ≤ 1, se debe iniciar la reducción gradual de corticosteroides y continuar durante al menos 1 mes. Con base en datos limitados de estudios clínicos en pacientes cuyas reacciones adversas inmuno-relacionadas no pudieron controlarse con el uso de corticosteroides, se puede considerar la administración de otros inmunosupresores sistémicos.1
- Se han notificado trastornos de la tiroides, incluidos hipotiroidismo, hipertiroidismo y tiroiditis, en pacientes que reciben pembrolizumab y puede ocurrir en cualquier momento durante el tratamiento. El hipotiroidismo es informado con mayor frecuencia en pacientes con HNSCC con radioterapia previa. Los pacientes deben ser monitoreados para detectar cambios en la función tiroidea (al comienzo del tratamiento, periódicamente durante el tratamiento y según lo indicado con base en la evaluación clínica) y los signos y síntomas clínicos de los trastornos de la tiroides. El hipotiroidismo se puede controlar con terapia de reemplazo sin interrupción del tratamiento y sin corticosteroides. El hipertiroidismo se puede manejar sintomáticamente. Pembrolizumab debe suspenderse para grados ≤ 3 hasta la recuperación hasta hipertiroidismo de grado ≤ 1. La función tiroidea y los niveles hormonales deben ser monitoreados para asegurar un reemplazo hormonal apropiado.1
- Se han notificado reacciones cutáneas graves inmuno-relacionadas en pacientes que reciben pembrolizumab. Los pacientes deben ser monitoreados en busca de sospechas de reacciones cutáneas graves y deben ser excluidas otras causas. En función de la gravedad de la reacción adversa, pembrolizumab debe interrumpirse en reacciones cutáneas de grado 3 hasta la recuperación a grado 1 o ser interrumpida permanentemente para reacciones cutáneas de grado 4, y se deben administrar corticosteroides.1
- Se han notificado casos de síndrome de Stevens-Johnson (SJS) y necrólisis epidérmica tóxica (TEN) en pacientes que reciben pembrolizumab. En caso de sospecha de SJS o TEN, pembrolizumab debe ser suspendido y el paciente debe ser remitido a un servicio especializado para su evaluación y tratamiento. Si se confirma S JS o TEN, pembrolizumab debe suspenderse permanentemente.1
- Se ha reportado el rechazo de trasplante de órganos sólidos en el entorno posterior a la comercialización en pacientes tratados con Inhibidores de PD-1. El tratamiento con pembrolizumab puede aumentar el riesgo de rechazar en los receptores de trasplantes de órganos sólidos. El beneficio del tratamiento con pembrolizumab frente al riesgo de posible rechazo del órgano debe ser evaluado en estos pacientes.1
- Se han observado casos de enfermedad de injerto contra huésped (GVHD) y enfermedad veno-oclusiva hepática (VOD) en pacientes con cHL sometidos a HSCT alogénico después de una exposición previa a pembrolizumab. Hasta que se disponga de más datos, se deben considerar caso por caso los posibles beneficios del HS CT y el posible aumento del riesgo de complicaciones relacionadas con el trasplante. Se han reportado GVHD aguda, incluida la GVHD mortal, después del tratamiento con KEYTRUDA® en pacientes con antecedentes de HSCT alogénico.1
- Se han notificado frecuencias superiores a las esperadas de elevaciones de ALT y AST de grados 3 y 4 en pacientes con RCC avanzado cuando pembrolizumab se administra con axitinib. Las enzimas hepáticas deben controlarse antes del inicio y periódicamente durante el tratamiento. Se puede considerar una monitorización más frecuente de las enzimas hepáticas en comparación como cuando los medicamentos se utilizan en monoterapia. Se deben seguir las pautas de manejo médico para ambos medicamentos.1
- Se han notificado reacciones relacionadas con la infusión, incluidas hipersensibilidad y anafilaxia, en pacientes que reciben pembrolizumab. Para reacciones a la infusión de grados 3 o 4, la infusión debe interrumpirse y el tratamiento con pembrolizumab suspenderse de forma permanente. Los pacientes con reacción a la infusión de grados 1 o 2 pueden continuar recibiendo pembrolizumab con una estrecha vigilancia; puede considerarse la premedicación con antipiréticos y antihistamínicos.1
Si sospecha que su paciente está experimentando una reacción ad versa inmuno-relacionada al tratamiento con KEYTRUDA®, evalúe para confirmar la etiología o excluir otras causas.
Según la gravedad de la reacción adversa, suspenda o interrumpa KEYTRUDA® y administre corticosteroides como se recomienda en esta herramienta.1
NEUMONITIS1
Monitoreo de pacientes
• Monitoree los signos y síntomas de neumonitis.
• Evalúe la sospecha de neumonitis con imágenes radiográficas.
Manejo de pacientes
• Administre corticosteroides para neumonitis de Grado 2 o mayor.
• Suspenda KEYTRUDA® para Grado 2; descontinúe permanentemente KEYTRUDA® por neumonitis de Grado 3 o 4 o recurrente de Grado 2.
COLITIS1
Monitoreo de pacientes
• Monitoree los signos y síntomas de colitis.
Manejo de pacientes
• Administre corticosteroides para colitis de Grado 2 o mayor.
• KEYTRUDA® debe suspenderse para colitis de Grado 2 o Grado 3, y ser descontinuado de forma permanente para
colitis de grado 4 o grado 3 recurrente.
HEPATITIS1
Monitoreo de pacientes
• Monitoree a los pacientes para detectar cambios en la función hepática y síntomas de hepatitis.
Manejo de pacientes
• Administre corticosteroides para hepatitis de Grado 2 o superior y, según la gravedad de las elevaciones de las
enzimas hepáticas, suspenda o interrumpa KEYTRUDA®.
ENDOCRINOPATÍAS1
Monitoreo de pacientes
• Monitoree a los pacientes en busca de signos y síntomas de insuficiencia suprarrenal e hipofisitis (incluido hipopituitarismo). También monitoree cambios en la función tiroidea o hiperglucemia u otros síntomas y signos de diabetes.
Manejo de pacientes
• Administre corticosteroides para tratar la insuficiencia suprarrenal y el reemplazo hormonal según esté clínicamente indicado. Suspenda KEYTRUDA® para Grado 2 y suspenda o interrumpa para insuficiencia suprarrenal o hipofisitis sintomática de Grado 3 o 4.
• El hipotiroidismo se puede manejar con terapia de reemplazo, sin interrupción del tratamiento y sin corticosteroides. Suspenda KEYTRUDA® para grado ≥ 3 hasta la recuperación del hipertiroidismo de Grado ≤ 1.
• Administre insulina para la diabetes tipo 1 y suspenda KEYTRUDA® en casos de diabetes tipo 1 asociada con hiperglucemia Grado ≥ 3 o cetoacidosis hasta que se logre el control metabólico.
NEFRITIS1
Monitoreo de pacientes
• Monitoree a los pacientes para detectar cambios en la función renal y excluir otras causas de disfunción renal.
Manejo de pacientes
• Administre corticosteroides para nefritis de Grado 2 o mayor.
• Suspenda KEYTRUDA® para la nefritis de Grado 2 y descontinúe permanentemente KEYTRUDA® para la nefritis de Grado 3 o 4.
REACCIONES ADVERSAS DE LA PIEL1
Monitoreo de pacientes
• Monitoree a los pacientes para detectar posibles reacciones cutáneas graves y excluir otras causas.
• Según la gravedad de la reacción adversa, el pembrolizumab debe suspenderse para las reacciones cutáneas de Grado 3 hasta la recuperación a Grado ≤ 1 o suspenderse permanentemente para las reacciones cutáneas de Grado 4, y se deben administrar corticosteroides.
• Para signos o síntomas de síndrome de Stevens-Johnson (SJS) o necrólisis epidérmica tóxica (TEN), suspenda KEYTRUDA® y remita al paciente a atención especializada para evaluación y tratamiento. Si se confirma SJS o TEN, interrumpa permanentemente KEYTRUDA®.
OTRAS REACCIONES ADVERSAS INMUNO-RELACIONADAS CLÍNICAMENTE IMPORTANTES1
Monitoreo de pacientes
• Para las sospechas de reacciones adversas inmuno-relacionadas, asegúrese de una evaluación adecuada para confirmar la etiología o excluir otras causas.¹
Manejo de pacientes
• Según la gravedad de la reacción adversa, suspenda KEYTRUDA® y administre corticosteroides.¹
• Con base en la gravedad de la reacción adversa, suspenda pembrolizumab para eventos Grados 2 y 3 y administre corticosteroides.
• El pembrolizumab puede reiniciarse 12 semanas después de la última dosis de KEYTRUDA® si la reacción adversa regresa a Grado ≤ 1 y la dosis de corticosteroides ha sido reducida a ≤ 10 mg de prednisona o su equivalente por día.
• Se debe interrumpir permanentemente pembrolizumab para cualquier reacción adversa inmuno-relacionada Grado 3 que sea recurrente y para cualquier reacción adversa inmuno-relacionada Grado 4.¹
REACCIONES RELACIONADAS CON LA INFUSIÓN1
Monitoreo de pacientes
• Se han notificado reacciones graves relacionadas con la infusión, incluyendo hipersensibilidad y anaflilaxia, en pacientes que reciben pembrolizumab. Para las reacciones a la infusión de Grado 3 o 4 se debe interrumpir la infusión y suspender permanentemente KEYTRUDA®, para Grados 1 y/o 2 pueden continuar recibiendo KEYTRUDA® con vigilancia estrecha; se puede considerar la premedicación con antipiréticos y antihistamínicos.
COMPLICACIONES DEL HSCT ALOGÉNICO1
HSCT alogénico antes del tratamiento con KEYTRUDA®
• En pacientes con antecedentes de HSCT alogénico, se ha notificado GVHD aguda, incluida GVHD mortal, después del tratamiento con pembrolizumab.
• Considere el beneficio de KEYTRUDA® vs. el posible riesgo de GVHD en pacientes con antecedentes de HSCT
alogénico.
HSCT alogénico después del tratamiento con pembrolizumab.
• Se han observado casos de enfermedad de injerto contra huésped (GVHD) y enfermedad veno-oclusiva hepática (VOD) en pacientes con cHL que se sometieron a HSCT alogénico después de una exposición previa a pembrolizumab. Hasta que se disponga de más datos, se deben considerar caso por caso los posibles beneficios del HSCT y el posible aumento del riesgo de complicaciones relacionadas con el trasplante.
Información Seleccionada de Seguridad completa – KEYTRUDA®
Abreviaturas:
5-FU = 5-fluorouracilo; ALT = alanina aminotransferasa; AST = aspartato aminotransferasa; C2S = cada 2 semanas; C3S = cada 3 semanas; cHL = linfoma de Hodgkin clásico; CRC = carcinoma colorrectal; HNSCC = carcinoma de células escamosas de cabeza y cuello; HSCT = trasplante de células progenitoras hematopoyéticas; NSC LC = carcinoma de pulmón de células no pequeñas; PD-1 = receptor de muerte programada 1; PD-L1 = ligando 1 de muerte programada; RC C = carcinoma de células renales.
Referencias:
- Información para prescribir KEYTRUDA ®
- Tahara M, Greil R, Rischin D y cols. Pembrolizumab with or without chemotherapy for first-line treatment of recurrent/metastatic (R/M) head and neck squamous cell carcinoma (HNSCC): 5 -year results from KEYNOTE-048. Abstract. Annals of Oncology. 2022; 33 (suppl_7): S295-S322. 10.1016/annonc/annonc1056.
09-23-LA-OHN-00024